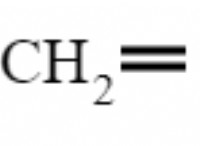1. 전해질 : 전기 분해는 용액 또는 용융 물질을 함유 한 전해질을 필요로한다. 이 이온은 전기를 수행하는 열쇠입니다.
2. 음이온 및 양이온 :
* 음이온 : 양극 에 끌리는 음으로 하전 된 이온 (양의 전극).
* 양이온 : 캐소드 에 끌리는 양으로 하전 된 이온 (음성 전극).
3. 마이그레이션 및 퇴원 :
* 전압이 가해지면 음이온은 양극을 향해 이동하고 양이온은 캐소드로 이동합니다.
* 전극에서, 이들 이온은 배출 라는 과정을 겪습니다. . 이곳에서 전자를 얻거나 잃는 곳으로 화학 반응이 발생합니다.
4. 예 :
* 물의 전기 분해 : 물 분자는 HAT (양이온) 및 OH (음이온)로 약간 이온화됩니다. 캐소드에서, h, 이온은 수소 가스를 형성하기 위해 전자를 얻는다 (H₂). 양극에서, OH 이온은 산소 가스를 형성하기 위해 전자를 잃어 버린다.
* 염화나트륨의 전기 분해 : 용융 NaCl에서, Na⁺ 양이온은 음극을 향해 이동하여 전자를 얻기 위해 전자를 얻습니다 (NA). Cl⁻ 음이온은 양극을 향해 이동하여 전자를 잃어 염소 가스 (Cl₂)를 형성합니다.
5. 산화 환원 반응 : 전기 분해 동안 전극에서 발생하는 화학 반응은 산화 환원 반응 입니다. :
* 감소 : 전자의 이득 (음극에서 발생).
* 산화 : 전자의 손실 (양극에서 발생).
요약하면, 음이온과 양이온은 전기 분해에 필수적입니다.
* 전기를 전환 : 그들의 움직임은 전류의 흐름을 허용합니다.
* 화학 반응에 참여 : 그들은 전극에서 전자를 얻거나 잃어 새로운 물질의 형성으로 이어집니다.
음이온과 양이온의 역할을 이해함으로써, 우리는 금속 정제에서 화학 물질 생산에 이르기까지 전기 분해의 원리와 다양한 응용 분야를 더 잘 이해할 수 있습니다.