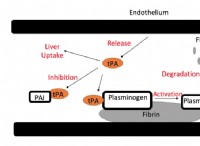
Arrhenius 산 :
* 정의 : Arrhenius acid는 물에 용해 될 때 수소 이온의 농도를 증가시키는 물질입니다 (H+) .
* 예 : 물 중의 염산 (HCl)은 H+ 및 클리온을 생성하여 H+ 농도를 증가시킨다.
* 일반 공식 : HA (여기서 H는 수소 이온이고 A는 음이온) → H + + A-
Arrhenius 기지 :
* 정의 : Arrhenius베이스는 물에 용해 될 때 수산화물 이온의 농도를 증가시키는 물질입니다 (OH-) .
* 예 : 수산화 나트륨 (NAOH)은 Na+ 및 OHION을 생성하여 OH- 농도를 증가시킨다.
* 일반 공식 : Boh (여기서 B는 양이온이고 OH는 수산화 이온) → B + + OH-
키 포인트 :
* 물에 중점을 둡니다 : Arrhenius 개념은 수성 솔루션 (물 솔루션)에 따라 다릅니다.
* 제한된 범위 : 그것은 물에서 H+ 또는 오리온을 생성하는 산 및 염기에만 적용됩니다.
* 중화 : Arrhenius 산과 염기는 반응하여 물과 소금을 형성하여 중화로 알려진 과정입니다.
* 예 : HCl (산) + NaOH (베이스) → NaCl (염) + H2O (물)
한계 :
* 보편적이지 않음 : Arrhenius 개념은 비-수성 용매에서 산과 염기의 거동을 설명하지 않습니다.
* 누락 된 반응 : H+ 또는 OHION과 관련이없는 산- 염기 반응을 설명 할 수는 없습니다.
현대 개념 :
Arrhenius 개념은 나중에 Brønsted-Lowry와 Lewis에 의해 확장되었으며, 이는 산과 염기의 더 넓고 포괄적 인 정의를 제공합니다. 그러나, Arrhenius 개념은 수용액에서 기본적인 산-염기 화학을 이해하는 데 유용합니다.