이유는 다음과 같습니다.
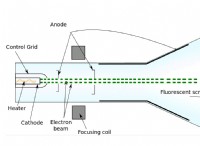
* 동역학 분자 이론 구성 입자 (원자 및 분자)의 운동 측면에서 물질의 거동을 설명하는 모델입니다. 그것은 모든 물질이 일정한 움직임으로, 운동 정도는 온도에 따라 증가합니다.
다른 옵션이 왜 잘못되었는지 살펴 보겠습니다.
* 질량 보존 법칙 : 이 법은 일반적인 화학적 및 물리적 변화로 질량을 만들거나 파괴 할 수 없다고 명시하고 있습니다. 물질의 움직임을 직접 다루지 않습니다.
* Boyle의 법칙 : 이 법은 일정한 온도에서 가스의 압력과 부피 사이의 역 관계를 설명합니다. 물질의 움직임을 직접 다루지 않습니다.
* 찰스의 법칙 : 이 법은 일정한 압력에서 가스의 부피와 온도 사이의 직접적인 관계를 설명합니다. 물질의 움직임을 직접 다루지 않습니다.
* Avogadro의 가설 : 이 가설은 동일한 온도와 압력에서 동일한 부피의 가스가 동일한 수의 분자를 함유한다는 것을 나타냅니다. 그것은 물질의 양과 관련이 있지만 모든 물질이 움직이고 있다고 명시 적으로 명시하지는 않습니다.
* 두더지 : 두더지는 물질의 양에 대한 측정 단위입니다. 물질의 움직임을 설명하지 않습니다.
따라서, 동역학 분자 이론 모든 문제가 움직이고 있다고 직접 언급하는 유일한 법입니다.