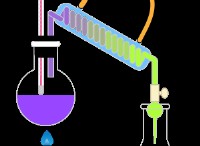
오픈 시스템 :
* 정의 : 에너지와 물질을 주변 환경과 교환 할 수있는 시스템.
* 예 : 스토브에 물 한 냄비, 살아있는 유기체, 열린 용기의 연소 반응.
화학 반응 중에 열린 시스템에서 발생하는 일 :
* 에너지 교환 :
* 열 : 열은 흡수 (흡열 반응) 또는 시스템에서 주변으로 방출 될 수 있습니다 (발열 반응).
* 빛 : 일부 반응은 빛 에너지를 방출합니다 (예 :타는 목재).
* 물질 교환 :
* 반응물 : 반응물을 시스템에 추가 할 수 있습니다.
* 제품 : 제품은 시스템에서 빠져 나올 수 있습니다 (예 :이산화탄소와 같은 가스).
* 다른 물질 : 시스템은 수증기 또는 용해 된 가스와 같은 다른 물질을 얻거나 잃을 수 있습니다.
개방 시스템의 결과 :
* 반응 속도 : 개방 시스템에서의 반응 속도는 물질 교환의 영향을받을 수 있습니다. 예를 들어, 더 많은 반응물을 추가하면 반응 속도를 높이면 제품을 제거하면 속도가 높아질 수 있습니다.
* 평형 : 일부 반응은 개방 시스템에서 평형에 도달하며, 여기서 전방 반응의 속도는 역 반응의 속도와 동일합니다. 그러나, 반응물 또는 생성물의 첨가 또는 제거에 의해 평형 위치를 이동시킬 수있다.
* 실제 시사점 : 일상 생활의 많은 화학 반응은 개방형 시스템에서 발생하므로 에너지와 물질 교환이 반응에 미치는 영향을 고려하는 것이 중요합니다.
요약 : 개방형 시스템의 화학 반응은 역동적이며, 에너지와 물질이 시스템과 환경 사이에서 자유롭게 움직일 수있어 반응의 속도, 평형 및 전반적인 결과에 영향을 미칩니다.