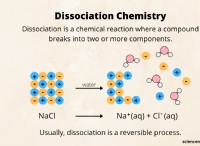
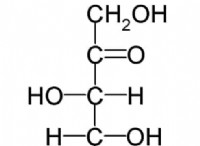
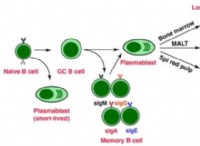
공식 :
* [h [o⁺] =10 ⁻ph
어디:
* [h [o⁺] 히드로 늄 이온의 몰 농도를 나타냅니다.
* pH 수소 이온 농도의 음성 로그입니다.
설명 :
* pH 스케일 : pH 스케일은 용액의 산도 또는 알칼리도를 측정합니다. pH가 낮 으면 더 높은 농도의 HALES 이온 (더 산성)을 나타내는 반면, PH가 높을수록 HALION 이온 (더 많은 알칼리성)을 나타냅니다.
* 히드로 늄 이온 (h₃o⁺) : 수성 용액에서는 수소 이온 (HAT)은 독립적으로 존재하지 않습니다. 대신, 이들은 수 분자와 결합하여 하이드로 늄 이온을 형성한다 (H₃O⁺).
* 관계 : 하이드로 늄 이온의 몰 농도는 수소 이온 농도와 직접 관련이 있으며, 이는 pH 스케일의 기초이다.
예 :
용액의 pH가 3 인 경우, 하이드로 늄 이온의 몰토리성은 다음과 같습니다.
* [HATER] =10 ³ =0.001 m
키 포인트 :
* 공식은 히드로 늄 이온의 농도가 유의 한 수용액에 적용됩니다.
* 순수한 물에서, pH는 7이며, 이는 하이드로 늄 이온의 몰 변이 10 ℃ (매우 낮음)입니다.
* 산은 더 높은 농도의 하이드로 늄 이온 (더 낮은 pH)을 갖는 반면, 염기는 더 낮은 농도의 하이드로 늄 이온 (높은 pH)을 갖는다.