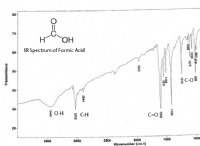
1. 극성 차이 :
* 물 (h>o) 산소와 수소 원자 사이의 전기 음성 차이로 인해 고도로 극성 분자입니다. 이것은 강한 쌍극자 모멘트와 수소 결합의 형성을 초래한다.
* 디 에틸 에테르 (ch₃ch₂och₂ch₃) 비교적 비극성 분자입니다. 그것은 약간 극성 C-O 결합을 가지지 만, 전체 분자는 균형을 잡고 중대한 극성이 부족합니다.
2. 수소 결합 :
* 물 분자는 수소 결합을 통해 서로 강력하게 상호 작용하여 응집력있는 네트워크를 형성합니다.
* 디 에틸 에테르는 물 분자와 수소 결합을 형성하는 능력이 부족합니다.
3. 분자간 힘 :
* 물 분자 사이의 강한 수소 결합은 쌍극자 쌍극자 상호 작용 또는 디 에틸 에테르와 물 분자 사이의 반 데르 발스 힘보다 훨씬 강합니다.
4. "좋아요":
* "처럼 용해 된 것"의 원리는 비슷한 극성을 가진 물질이 서로 녹는 경향이 있다고 말합니다. 디 에틸 에테르는 비극성이고 물은 극성이기 때문에, 그것들은 호환되지 않으며 비밀리에 남아 있습니다.
결론 :
극성의 유의 한 차이, 수소 결합 능력의 부족 및 디 에틸 에테르와 물 사이의 약한 분자간 힘은 그들의 비도성을 초래한다. 그것들은 혼합 될 때 두 개의 별도의 층을 형성하며, 밀도가 낮은 물 위에 덜 조밀 한 디 에틸 에테르가 떠 다니고있다.