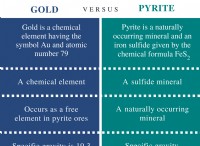
1. 분자식에서 경험적 공식을 찾으십시오 :
* 분자식 C6H12는 이미 화합물에서 원자의 가장 간단한 전체 수비율을 나타냅니다. 따라서 경험적 공식은 또한 ch2 입니다 .
2. 어금니 질량으로 확인하십시오 :
* 경험적 공식 (CH2)의 몰 질량을 계산합니다.
* C :12.01 g/mol
* H :1.01 g/mol
* CH2의 어금니 질량 =12.01 + (1.01 * 2) =14.03 g/mol
* 주어진 어금니 질량과 비교 :
주어진 몰 질량은 84.16 g/mol입니다.
* 주어진 어금니 질량을 경험적 공식 몰 질량으로 나눕니다 :84.16 g/mol/14.03 g/mol ≈ 6
* 이것은 경험적 공식이 정확하다는 것을 확인합니다.
따라서, 화합물의 적절하게 쓰여진 경험적 공식은 CH2입니다.