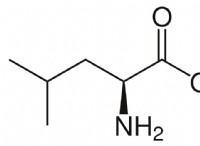
그러나이 용어는 종종 느슨하게 사용되며 오해의 소지가 있습니다. 이유는 다음과 같습니다.
* 자발적 반응이 항상 빠르지는 않습니다. 자발적 반응은 열역학적으로 유리한 반응으로, 이는 제품이 반응물보다 깁스 자유 에너지가 낮다는 것을 의미합니다. 그렇다고 반응이 빨리 발생한다는 의미는 아닙니다. 에너지 장벽을 극복하기 위해 활성화 에너지가 필요한 것은 매우 느릴 수 있습니다.
* 많은 반응에는 특정 조건이 필요합니다. 반응이 자발적이더라도 특정 조건이 충족되지 않으면 발생하지 않을 수 있습니다. 여기에는 다음이 포함될 수 있습니다.
* 온도 : 일부 반응은 고온에서만 발생합니다.
* 촉매의 존재 : 촉매는 활성화 에너지를 낮추어 반응 속도를 높입니다.
* 반응물의 농도 : 반응 속도는 종종 반응물의 농도에 의존한다.
* 압력 : 일부 반응은 압력, 특히 가스와 관련된 반응에 의해 영향을받습니다.
반응물을 모아서 단순히 발생하는 반응을 설명하는 더 좋은 방법은 라고 말하는 것입니다. 직접 반응 또는 조합 반응 .
다음은 자발적으로 간주 될 수있는 반응의 예입니다.
* 연소 : 산소가있는 경우 나무를 태우십시오. 이것은 자발적으로 일단 점화되었습니다.
* 중화 : 산과 염기를 혼합하여 소금과 물을 형성합니다. 이것은 자발적이며 종종 빠르게 발생합니다.
* 녹음 : 산소 및 물과 반응하여 산화철 (녹)을 형성합니다. 이것은 자발적이지만 천천히 발생합니다.
"자발적"이라는 용어는 반응이 그 자체로 발생한다는 것을 암시한다는 것을 기억하는 것이 중요합니다. 그렇다고해서 특정 조건이 없으면 발생한다는 의미는 아닙니다.