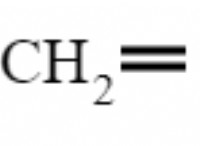1. 개념을 이해하십시오
* 연소의 엔탈피 : 이것은 물질의 한 몰이 산소와의 완전한 연소를 겪을 때 방출 된 열입니다. 일반적으로 ΔH °
* Isooctane (C 8 h 18 ) : 가솔린의 공통 성분으로, 종종 기준 연료로 사용됩니다.
2. isooctane 에 대한 연소 엔탈피를 찾으십시오
* 이소 옥탄에 대한 연소의 표준 엔탈피를 찾아야합니다 (ΔH °
3. 이소 옥탄의 두더지를 계산하십시오
* Isooctane의 몰 질량 : 114.23 g/mol
* 이소탄 질량 : 2.6 kg =2600 g
* isooctane의 두더지 : (2600 g) / (114.23 g / mol) =22.8 mol
4. 총 엔탈피 변화를 계산하십시오
* 엔탈피 변화 : (22.8 mol) × (-5460 kj/mol) = -124,848 kj
따라서, 1 갤런의 이소 옥탄 연소에 대한 엔탈피의 변화는 약 -124,848 kJ이다. 이것은 큰 음수 값으로 연소 중 열의 상당한 방출을 나타냅니다.
중요한 고려 사항 :
* 단위 : 모든 단위가 일관성이 있는지 확인하십시오 (예 :엔탈피의 경우 KJ, 질량의 경우 G, 두더지의 MOL).
* 표준 조건 : 연소의 엔탈피는 일반적으로 표준 조건 (298k 및 1 atm)에서 제공됩니다.
* 불완전한 연소 : 연소가 완료되지 않으면 실제 엔탈피 변화는 약간 다를 수 있습니다.