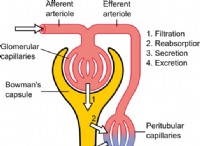
네온 (NE) 대 질소 (N)
* 전자 수 : 네온에는 10 개의 전자가 있고 질소에는 7 개의 전자가 있습니다. 이 근본적인 차이는 전자가 BOHR 모델에서 어떻게 배열되는지를 지시합니다.
* 전자 구성 :
* 네온 : 첫 번째 쉘 (k 쉘)의 전자 2 개, 두 번째 쉘 (L 쉘)의 8 개의 전자.
* 질소 : 첫 번째 쉘 (k 쉘)의 2 개의 전자, 두 번째 쉘 (L 쉘)의 5 개의 전자.
* 껍질 수 : 네온과 질소는 BoHR 모델에 2 개의 전자 껍질을 가지고 있습니다.
* 안정성 :
* 네온 : 네온에는 외부 쉘 (8 개의 전자)이있어 고귀한 가스와 매우 안정적입니다.
* 질소 : 질소는 부분적으로 채워진 외부 껍질 (5 전자)을 가지므로 네온보다 반응성이 높고 안정적이지 않습니다.
시각적 표현 :
* 네온 : 네온의 Bohr 모델은 두 개의 껍질로 둘러싸인 10 개의 양성자와 10 개의 중성자 (가장 일반적인 동위 원소를 가정)를 갖는 핵을 나타낼 것이다. 첫 번째 쉘에는 2 개의 전자가 있고, 두 번째 쉘에는 8 개의 전자가 채워질 것입니다.
* 질소 : 질소의 BOHR 모델은 2 개의 껍질로 둘러싸인 7 개의 양성자 및 7 개의 중성자 (가장 일반적인 동위 원소를 가정)를 갖는 핵을 나타낼 것이다. 첫 번째 쉘에는 2 개의 전자가 있고 두 번째 쉘에는 5 개의 전자가 있습니다.
키 포인트 :
* 가장 바깥 쪽 쉘의 전자 수는 요소의 반응성을 결정합니다.
* Neon과 같은 귀족 가스는 외부 껍질이 완전히 채워져 있기 때문에 불활성입니다.
* 원자는 종종 고귀한 가스와 비슷한 전자를 얻거나 잃어버린 안정적인 전자 구성을 달성하기 위해 노력합니다.
이 점들에 대한 다이어그램이나 더 설명을 원하시면 알려주십시오!