보편적 인 지표 광범위한 pH 값에 걸쳐 여러 가지 색상 변화를 표시하는 pH 지표입니다. 리트머스 용지 및 개별 pH 지표와 마찬가지로, 보편적 인 지표는 솔루션의 알칼리도의 산도를 나타냅니다. 그러나 개별 염료는 일반적으로 좁은 pH 범위에서 색상을 바꾸는 반면, 범용 지표는 산, 중립 용액 및 기초에 작동하며 전체 무지개를 바꿉니다.
범용 표시기 차트
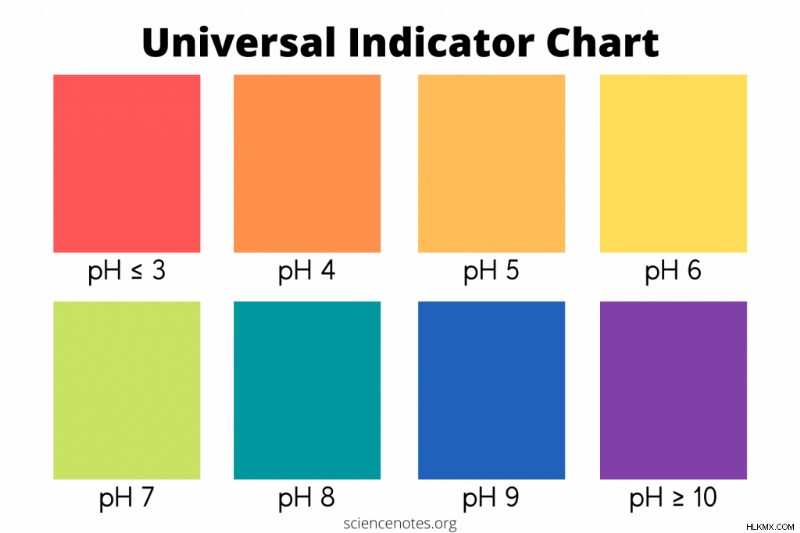
교실, 실험실 또는 집에서 사용하기 위해 Universal Indicator 차트를 다운로드하여 인쇄 할 수 있습니다. 이 표는 범용 표시기 솔루션의 일반적인 색상과 pH 값을 나열합니다.
| PH 범위 | 설명 | 색상 |
| <3 | 강한 산성 | 빨간색 |
| 3-4 | 산성 | 오렌지 |
| 5 | 약산 | 노란색 오렌지 |
| 6 | 약간 산성 | 옐로우 |
| 7 | 중립 | 녹색 |
| 8 | 약간 알칼리성 | 청색 녹색 |
| 9 | 약한 알칼리 | 블루 |
| > 10 | 강하게 알칼리성 | 바이올렛 |
이 색상은 보편적 인 지표의 염료 간의 상호 작용에서 비롯된데, 이는 일반적으로 티몰 블루, 메틸 오렌지, 메틸 레드, 브로 모시 멜 블루 및 페놀프탈 라인입니다 :
| 표시기 | 낮은 pH 색상 | 전환 범위 | 높은 pH 색 |
| Thymol Blue (첫 번째 전환) | 빨간색 | 1.2 - 2.8 | 옐로우 |
| 메틸 오렌지 | 빨간색 | 3.2 - 4.4 | 옐로우 |
| 메틸 레드 | 빨간색 | 4.8 - 6.0 | 옐로우 |
| Bromothymol Blue | 옐로우 | 6.0 - 7.6 | 블루 |
| Thymol Blue (두 번째 전환) | 옐로우 | 8.0 - 9.6 | 블루 |
| Phenolphthalein | 무색 | 8.3 - 10.0 | 분홍색 또는 빨간색 |
컬러 차트는 실험에 좋은 출발점이지만 지표 솔루션을 보정하는 것이 가장 좋습니다. 알려진 pH 값의 화학 물질 테스트에서 실제 색상을 기록하십시오.

보편적 인 지표를 만드는 방법
Universal Indicator 솔루션은 온라인으로 쉽게 구할 수 있습니다. 그러나 직접 만드는 것은 쉽습니다. 몇 가지 보편적 인 지표 레시피가 있습니다. 대부분은 1933 년의 야마다 특허의 변형입니다.
클래식 범용 지표 솔루션 레시피
- 메틸 레드
- Phenolphthalein
- Bromothymol Blue
- 95% 에탄올
- 증류수
- 550 ml의 95% 에탄올에 0.18 g 메틸 레드 및 0.36 g Phenolphthalein을 용해시킵니다.
- 별도의 용기에 300ml의 증류수에 0.43g 브로모시 폴 블루를 녹인다.
- 두 용액을 함께 혼합하고 증류수를 사용하여 1 L의 최종 부피로 희석하십시오.
- 지표 솔루션이 녹색으로 변할 때까지 0.1m 수산화 나트륨 (NAOH)을 떨어 뜨립니다.
표시된 용기에 표시기 솔루션을 저장하십시오. 그것은 약 3 년의 저장 수명을 가지고 있습니다.
쉬운 보편적 인 지표 레시피
이 레시피는 더 많은 표시기 염료를 사용하지만 더 적은 단계가 필요합니다.
- 0.1 g Phenolphthalein
- 0.2 g 메틸 레드
- 0.3 g 메틸 오렌지
- 0.4 G Bromothymol Blue
- 0.5 g Thymol Blue
- 염료를 250 ml 에탄올과 250 ml 물의 혼합물로 용해 시키십시오.
Universal Indicator 솔루션은 밀봉 된 용기에 약 3 년 동안 유통 기한이 있습니다.
양배추 주스 유니버설 지표 레시피
빨간색 또는 자주색 양배추 주스를 사용하는 것은 경제적이고 무독성 솔루션입니다. 대부분의 다른 자연 pH 지표와 달리 양배추 주스는 다양한 색상을 표시합니다.
- 빨간색 또는 자주색 양배추를 자르거나 섞습니다. 블렌더를 사용하는 경우 필요한 최소 물을 추가하십시오.
- 혼합 양배추가 부드러워 질 때까지 전자 레인지. 또는 스토브에서 요리하십시오.
- 양배추를 식히십시오.
- 스트레이너를 사용하고 액체를 여과하십시오.
양배추 주스 지표는 몇 주 동안 냉장고 또는 사용할 때까지 얼어 붙은 경우 무기한으로 지속됩니다. 이 표시기에는 컬러 차트가 있지만 각 양배추는 약간 다른 양의 다양한 안토시아닌이 포함되어 있기 때문에 직접 만드는 것이 좋습니다.
보편적 인 지표 pH 종이
를 만드십시오
보편적 인 지표가 있으면 pH 용지를 만드는 것이 간단합니다. 지표 솔루션과 함께 여과지를 담그십시오. 가장 쉬운 청소를 위해 Dropper를 사용하여 표시기 솔루션을 적용하십시오. 종이를 건조시키고 테스트 스트립으로 자릅니다.
테스트 스트립을 액체에 담그지 마십시오! 드롭퍼를 사용하고 스트립의 한쪽 끝에 테스트 액체 한 방울을 바릅니다. 그런 다음 차트와 색상을 비교하십시오.
참조
- 포스터, L.S.; Gruntfest, I. J. (1937). "보편적 인 지표를 사용한 데모 실험". 화학 교육 저널 . 14 (6) :274. doi :10.1021/ed014p274
- Rasouli, Zahra; 압둘라이, 하미드; Maeder, Marcel (2020). "용액 pH의 일반 지표 기반 결정". Analytica Chimica Acta . 1109 :90-97. doi :10.1016/j.aca.2020.03.004
- Schwarzenbach, Gerold (1957). 복잡한 적정성 . Irving, Harry (1st English ed.)에 의해 번역. 런던 :Methuen &Co.
- Walker, Denise (2007). 산 및 알칼리 (첫 번째 ed.). 런던 :에반스. ISBN 0-237-53002-3.
- Zumdahl, Steven S. (2009). 화학 원리 (6th ed.). 뉴욕 :Houghton Mifflin Company.









