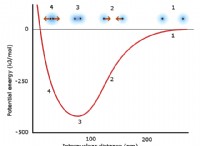
기본 단계 :반응 메커니즘의 빌딩 블록
초등학교 단계 반응에서 발생하는 단일의 근본적인 과정입니다. 반응 메커니즘의 가장 기본적인 단계는 한 번에 하나 또는 두 분자 만 포함합니다. 이 단계는 빌딩 블록입니다 전체 반응의.
기본 단계는 반응 메커니즘과 관련된 방법입니다.
1. 메커니즘 분석 :
* 반응 메커니즘은 반응이 어떻게 발생하는지에 대한 단계별 설명입니다. 반응물에서 생성물로의 경로를 설명하는 일련의 개별 기본 단계입니다.
* 각 기본 단계는 결합의 파괴, 새로운 결합의 형성 또는 두 분자의 충돌과 같은 특정 분자 사건을 나타냅니다.
2. 분자 :
* 기본 단계는 분자로 분류됩니다.
* 분자 분자 : 변화가 발생하는 단일 분자 (예 :분해)를 포함합니다.
* 이질성 : 충돌 및 상호 작용 (예 :반응으로 이어지는 충돌)을 포함합니다.
* 용어 분자 : 3 개의 분자의 동시 충돌이 포함됩니다 (이러한 사건의 확률이 낮기 때문에 드물다).
3. 법률 및 실험 데이터 :
* 기본 단계의 요금 법은 분자에 의해 직접 결정됩니다.
* 분자 단체 단계의 경우 요금 법률은 1 차입니다.
* 이질적인 단계의 경우, 요금 법률은 2 차입니다.
* 실험 데이터는 반응의 속도 법칙을 결정하고 메커니즘과 관련된 개별 기본 단계를 식별하는 데 사용될 수 있습니다.
4. 속도 결정 단계 :
* 종종 메커니즘의 한 단계는 다른 단계보다 훨씬 느립니다. 이것을 속도 결정 단계 (RDS) 라고합니다 .
* RDS는 반응의 전체 속도를 제어합니다.
* 반응의 동역학을 이해하는 데 RDS를 식별하는 것이 중요합니다.
예 :
메탄의 연소를 고려하십시오.
ch₄ + 2o₂ → co₂ + 2h₂o
이 반응은 한 단계에서 발생하지 않습니다. 대신 일련의 기본 단계가 포함됩니다.
1. 시작 : o₂ → 2o • (단 분자, 느린)
2. 전파 : ch₄ + o • → ch₃ • + h₂o (이분자)
3. 전파 : ch₃ • + o₂ → ch₂o • + + 오 • (이 분자)
4. 종료 : 2CH₂ • → C₃H₆ (이질성)
이 경우, 첫 번째 단계 (O₂ → 2o •)는 가장 느리기 때문에 RDS입니다. 이 단계는 연소 과정의 전체 속도를 결정합니다.
요약하면, 기본 단계는 반응 메커니즘의 기본 빌딩 블록입니다. 이러한 단계의 본질을 이해함으로써, 우리는 화학 반응의 복잡성을 풀고 그들의 속도와 메커니즘에 대한 통찰력을 얻을 수 있습니다.