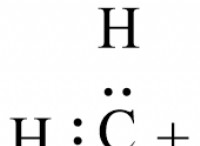이유는 다음과 같습니다.
* Alkenes는 광범위한 종류의 탄화수소입니다. 그들은 모두 이중 결합을 가지고 있지만 크기, 모양 및 가지는 크게 다를 수 있습니다.
* 끓는점은 분자 크기와 구조에 의해 영향을받습니다 :
* 더 큰 알켄은 더 높은 비등점을 가지고 있습니다. 이것은 더 큰 분자들 사이의 런던 분산 힘 (임시 쌍극자)이 증가했기 때문입니다.
* 분지 된 알켄은 끓는점이 낮습니다. 분지는 표면적을 감소시켜 분자간 힘이 약합니다.
예는 다음과 같습니다.
* ethene (C2H4) : 끓는점 -103.7 ° C (매우 낮음)
* 1- 헥센 (C6H12) : 끓는점 63.5 ° C (상당히 높은)
특정 알켄의 끓는점을 결정하려면 분자식과 구조를 고려해야합니다.