요소 및 기호 :
* 각 화학식은 요소 기호를 사용하여 존재하는 다른 유형의 원자를 나타냅니다. 예를 들어:
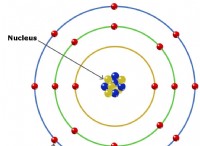
* H는 수소를 나타냅니다
* O는 산소를 나타냅니다
* C는 탄소를 나타냅니다
* NA는 나트륨을 나타냅니다
첨자 및 원자 수 :
* 구독은 아래에 작성된 소수이며 요소 기호의 오른쪽에 있습니다. 그들은 분자에서 그 요소의 원자 수를 나타냅니다. 첨자가 없으면 해당 요소의 원자가 하나뿐입니다.
* h₂o : 이 공식은 물 분자를 나타냅니다. 그것은 2 개의 수소 원자 (H₂)와 하나의 산소 원자 (O)를 갖는다.
* co₂ : 이 공식은 이산화탄소 분자를 나타냅니다. 그것은 하나의 탄소 원자 (c)와 2 개의 산소 원자 (O₂)를 갖는다.
예 :
* c ₆h>o₆ : 이것은 포도당 (설탕 유형)의 공식입니다. 그것은 우리에게 알려줍니다 :
* 6 개의 탄소 원자가 있습니다 (CAT).
* 12 개의 수소 원자가 있습니다 (HAT).
* 6 개의 산소 원자가 있습니다 (O₆).
중요한 메모 :
* 계수 : 때로는 전체 공식 앞에 숫자가 나타납니다. 이를 계수라고하며 전체 분자의 원자 수를 곱합니다. 예를 들어, 2H₂O는 2 개의 물 분자 (총 4 개의 수소 원자와 2 개의 산소 원자)를 나타냅니다.
* 이온 성 화합물 : 이온 성 화합물 (반대로 하전 된 이온의 인력에 의해 형성됨)의 경우, 공식은 화합물에서 이온의 가장 간단한 비율을 나타낸다. 예를 들어, NaCl (염화나트륨)은 하나의 클로라이드 이온 (Cl⁻)마다 하나의 나트륨 이온 (Na⁺)이 있음을 나타냅니다.
요약 :
화학적 공식은 분자의 조성을 나타내는 간결한 방법이며, 구조에 관련된 원자의 유형과 수를 명확하게 나타냅니다.