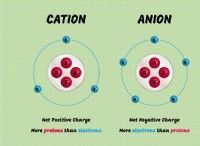
ΔU =Q -W
어디:
* ΔU 시스템의 내부 에너지의 변화입니다
* Q 열이 시스템에 추가되었습니다
* W 시스템이 수행 한 작업입니다
다음은 다음과 같습니다.
* 에너지는 생성하거나 파괴 될 수 없으며 전달되거나 변형되었습니다.
* 시스템의 내부 에너지 (ΔU)의 변화는 시스템 (w)에 의해 수행 된 작업을 뺀 시스템 (Q)에 추가 된 열과 같습니다.
이렇게 생각하십시오 :
* Q 시스템에 에너지를 추가하는 것과 같습니다 (예 :난방).
* W 시스템을 떠나는 에너지와 같습니다 (예 :피스톤 확장 및 작업).
* ΔU 시스템 내에서 에너지의 순 변화입니다.
예 :
* 시스템에 열을 추가하고 (Q가 양수) 시스템이 작동하면 (w가 양수) 내부 에너지 (ΔU)가 증가합니다.
* 시스템에서 열을 제거하고 (Q는 음수) 시스템에서 작업을 수행 한 경우 (w가 음수) 내부 에너지 (ΔU)가 감소합니다.
열역학의 첫 번째 법칙은 화학 반응을 포함한 모든 물리적 과정에 적용됩니다. 그러나 화학 방정식 자체가 아닙니다.