pH는 "P"를 의미하는 잠재적 수소를 나타 내고 잠재력과 수소에 대한 "H"를 의미합니다. pH 스케일 물질의 수소 이온 활성의 양에 따라 물질의 상대적 염기성 또는 산도를 다른 물질에 순위하는 데 사용되는 스케일입니다.
.척도는 본질적으로 로그이며, 즉 모든 전체 pH 값은 이전 값의 10 배의 변화를 나타냅니다. pH 스케일 pH 7을 기반으로하는데, 이는 중성이며 산이나 염기가 아닌 물질을 나타냅니다.
pH 스케일의 기초
산과 염기의 개념에 친숙하지 않더라도 확실히 그것에 노출 될 수 있습니다. 기본 물질은 베이킹 소다와 같은 것이며 산성 물질은 오렌지 주스와 소다와 같은 것입니다. 물질은 물질의 수소 이온의 농도에 따라 염기 또는 산 기반으로 분류됩니다. pH의 H는 주어진 용액에서 수소 이온 활성의 수준을 나타낸다. 따라서 이런 식으로 산성 및 기본 솔루션을 정의 할 수 있습니다.
산성 용액은 순수한 물에서 발견되는 양보다 큰 수소 이온 수준 (중성 7)을 갖는 용액이다. 대조적으로, 기본 용액은 수질보다 낮은 수소 이온 농도를 갖는다.
.
순수한 물은 pH 규모의 중립 지점으로 기능하기 때문에 물의 특성을 살펴보고 수소 이온의 맥락에서 배치합시다. 물의 이온화는 주어진 양의 물에서 물 분자의 일부가 어떻게 소량의 수소 이온이 해리되거나 더 작은 입자로 분할되는지를 나타냅니다. 이것은 때때로 자동 이온화라고합니다. 자가 이온화 과정은 동일한 수의 수산화물 (OH-) 이온 및 수소 (H+) 이온을 생성합니다. 수소 이온은 일반적으로 근처의 물 분자와 직접 결합하여 하이드로 늄 (H3O+)을 형성합니다. 이것은 실제로 물에 떠 다니는 수소 이온이 많이 없음을 의미합니다. 그러나 과학자들은 여전히 물의 이온화를 사용하여 다른 용액의 수준에서 수소를 비교할 수있는 스케일을 생성하는 방법으로 생산하는 수소 이온을 사용합니다. 수산화물 이온은 일반적으로 수소 이온과 달리 용액 내에서 떠 다니고 있습니다.
자가 이온화를 통해 생성 된 수소 이온의 수와 관련하여, 양은 1 x 10^-7 m (순수한 물이라고 가정)와 같습니다. 표기법은 물의 물당 두더지를 나타냅니다. 이온화 된 물 분자의 수는 순수한 물에서 발견되는 총 물 분자 수의 엄청나게 적은 비율입니다.
산 용액 및 기본 솔루션
솔루션의 염기성과 산도에 대한 기준점을 설정 했으므로 산과 염기가 어떻게 정의되는지 논의 할 수 있습니다. 산성 용액은 순수한 물보다 H+ 농도가 큰 솔루션 인 반면, 기본 용액은 순수한 물보다 H+ 농도가 낮은 용액입니다. 다른 방법으로 말하기 위해 :
base =h+ 농도 <1 x 10^-7 m
acid =h+ 농도> 1 x 10^-7 m
용액 내의 수소 이온의 농도는 일반적으로 pH 용어로 주어진다.
ph =-log10 [h+]
따라서 물의 수소 이온 농도를이 공식에 넣으면 7.0의 값 또는 pH 척도의 중성 pH를 얻을 수 있습니다. 당신이 추측 할 수 있듯이, 주로 세포에서 발견되는 시토 졸이나 인체의 혈액과 같은 물로 만든 물질은 pH 값이 중성 7에 매우 가까이 있습니다. 산 및 염기는 수성 용액에 첨가 될 수 있으며, 해당 용액의 농도를 중성 PH 포인트로부터 멀리 이동시킬 수 있습니다. 염기는 일반적으로 수소 이온을 수집하여 용액에서 벗어나게하는 환경으로 수산화물을 도입하여 pH 수준을 높입니다. 한편, 산성 물질은 수소 원자 중 하나를 용액에 해리하고 도입함으로써 수소 이온 농도를 증가시키는 것입니다.
산이 강력할수록 H+가 더 빨리 저하되고 방출됩니다. 강산의 예는 HCl이며, 이는 물과 결합 될 때 염화물과 수소의 이온으로 빠르고 완전히 분리됩니다. 대조적으로, 식초와 같은 약산은 완전히 분리되지 않습니다. 강력한 염기 물질은 물에있을 때 H+를 흡수 할 수있는 수산화물 이온을 방출하여 강산 물질과 매우 흡사합니다. 강력한 염기의 예는 수산화 나트륨입니다.
pH 스케일의 강도
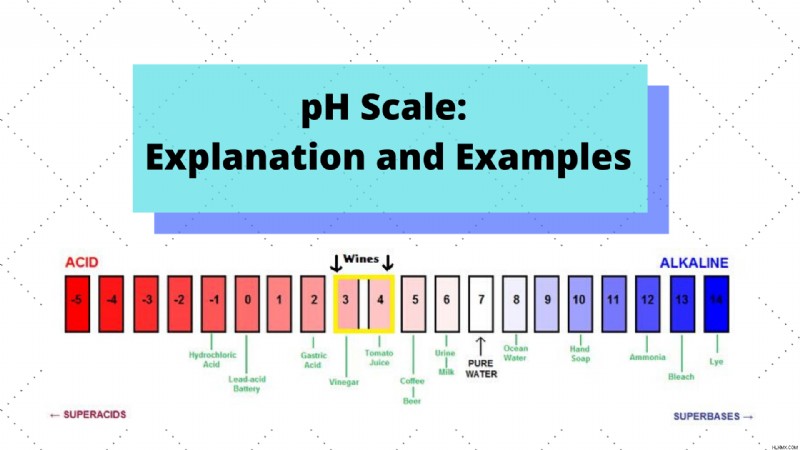
앞에서 언급 한 바와 같이, pH 척도는 기초성 (알칼리도라고도 함)과 산도 측면에서 다양한 화학 조성물을 순위로운 데 도움이됩니다. IS Logarithmic 특성은 발생하는 하나의 pH 단위의 증가에 대해 H+의 농도가 10 배 증가 함을 의미합니다. 0 ~ 14 pH 범위를 벗어날 수있는 물질이 있지만, 대부분의 용액은이 범위에 속하므로 pH 척도는 일반적으로 0에서 14로 실행되며 기본 물질은 7 이상의 값과 산성 물질이 중립 7보다 산성 물질입니다.
.pH 규모의 맨 끝에있는 물질, 매우 기본적이거나 매우 산성 물질은 유기 물질에 상당히 해로울 수 있으며, 세포에 상당한 손상을 입을 수 있습니다. 매우 기본적이고 산성이 높은 물질 모두 본질적으로 부식성이있어 사람들의 조직을 손상시킬 수 있습니다. 용액의 pH 및 1에 노출되는 용액의 양과 그에 노출되는 기간은 물질이 얼마나 손상 될지 결정하는 모든 요소입니다. 위산 인 위산은 산성이 매우 높다는 것을 알았을 것입니다. 당신의 몸은이 산으로부터 어떻게 스스로를 보호합니까? 위산과 신체의 다른 세포 사이의 장벽으로 작용하기 위해 특별히 생성 된 특정 위 세포가 있으며, 이는 끊임없이 생성되고 희생되고 있습니다.
예
공통 솔루션과 그들이 가지고있는 pH 값의 일부 예는 다음과 같습니다.
- 우유 - pH 값이 약 6.5 인 약간 산성.
- 비 - 약 5.5의 pH 값을 가진 약간 산성.
- 커피 - 약 4.8의 pH 값을 가진 가벼운 산성.
- 토마토 주스 - pH가 약 3.0 인 경미한 산성
- 배터리 산 - pH 값이 약 1.0 인 매우 산성입니다.
- 혈액 - 약 7.3의 pH를 가진 약간 기본
- 해수 - pH가 약 8.0 인 약간 기본.
- 베이킹 소다 - pH가 약 8.0 인 약간 기본.
- 마그네시아 우유 - 약 10.6의 pH를 가진 적당히 기본
- Lye - pH가 약 13.5 인 매우 기본적으로