
질산염, 화학적 공식 No3의 화학 전하는 -1입니다. 이온 질산염은 공식적인 전하가 음의 부정적인 것으로 나타납니다. 이것이 왜 그런지 궁금 할 것입니다. N03 -9의 전체 충전이 아닌 이유는 무엇입니까?
이를 이해하려면 NO3 분자 내의 원자 수를 살펴보고 공식 전하가 어떻게 계산되는지 이해해 봅시다.
공식 요금이란 무엇입니까?
공식 전하 또는 화학 전하는 화학적 결합 내에서 발견되는 전자가 분자를 구성하는 원자들 사이에서 동일하게 공유된다고 가정 할 때, 분자에 원자가 보유한다는 전하이다. 이것은 상대적인 전기 음성이 요인이 아님을 의미합니다.
공식 전하를 계산하기 위해, 전자는 두 가지 다른 규칙에 기초하여 분자 내의 개별 원자에 할당된다 :본딩 전자는 다른 결합 원자를 가로 질러 균등하게 분할되어야하며, 비 결합 전자는 그들이 위치한 원자의 일부로 간주됩니다.
.공식 전하를 결정하기위한 방정식은 다음과 같이 설명 할 수 있습니다.
공식 전하 =EV-en-eb/2
주어진다 :
- ev =원자가 원자가 분자의 나머지 부분에서 분리 된 것처럼 원자가 소유하는 총 원자가의 총 수.
- en =분자 내에 위치했을 때 원자가 가지고있는 결합되지 않은 원자가 전자의 총 수.
- EB =분자 내의 다른 원자에 원자를 연결하는 결합에 의해 공유되는 총 전자 수
공식 전하의 예
공식적인 전하 계산의 예를 살펴 보겠습니다 :
이산화탄소, CO2는 원자가 껍질에 16 개의 전자를 갖는 중성 분자입니다. 분자의 루이스 구조를 그리면 세 가지 다른 방식으로 스케치 될 수 있습니다. 탄소 원자는 이중 결합으로 주변의 산소 원자에 잠재적으로 결합 될 수 있거나, 탄소 원자는 이중 결합을 갖는 산소 원자 중 하나 및 단일 결합을 갖는 다른 산소 원자에 결합 될 수있다. 마지막으로, 탄소 원자는 단일 결합으로 두 산소 원자에 결합 될 수 있습니다.
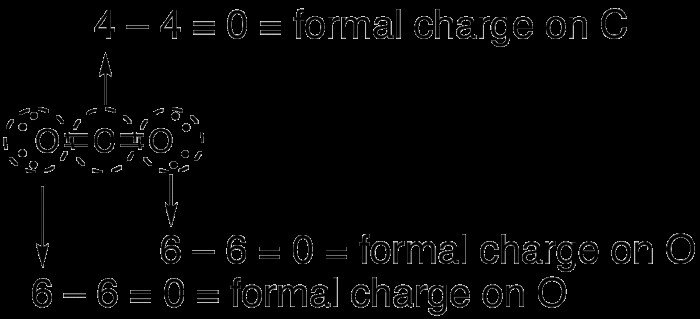
이산화탄소의 경우 분자의 가능한 모든 형성은 공식적인 전하가 0입니다. 첫 번째 경우 탄소와 산소는 모두 0의 전하를 가지므로 전체 전하가 발생합니다. 두 번째 경우, 탄소는 양의 1 전하를 가지며, 산소 이중 결합은 0의 전하를 가지며 산소 단일 결합은 -1의 전하를 가지며 순 공식 전하가 0이됩니다. 탄소는 +2의 전하가 있고 산소는 각각 -1 충전으로, 다시 공식적인 전하가 0입니다.
공식 요금의 또 다른 예를 살펴 보겠습니다.
화합물 테트라 하이드로 비워 또는 BH4의 공식적인 전하는 무엇입니까? BH4는 붕소와 수소로 만들어 졌으므로 두 요소 사이의 결합을 살펴 보겠습니다. BH4는 붕소 원자 주위에 비 결합 전자, 붕소 용 3 개의 원자가 전자 및 4 개의 결합을 갖지 않습니다. 이것을 공식 전하 공식의 표현으로 변환하면, 공식은 3 -(0 + 4) 또는 전체적으로 -1로 표현됩니다.
이제 분자의 수소 원자를 살펴 보겠습니다. 붕소와 마찬가지로, 수소는 비 결합 전자가 0이지만 하나의 원자가 전자와 단일 결합 만 있습니다. 이것은 BH4 내의 수소의 공식 전하가 1 - (0 + 1)이라는 것을 의미합니다. 이는 수소의 공식 전하가 0임을 의미합니다.
.공식 요금 및 루이스 구조
루이스 구조는 또한 전자 구조라고도하며, 분자를 구성하는 원자들 사이에 가능한 결합과 결합되지 않은 전자 쌍 사이의 결합을 보여주는 다이어그램이다. 루이스 구조의 선은 원자 사이에 그려지며 화학적 결합의 존재를 나타내는 데 사용됩니다. 단일 결합은 단일 라인으로 표시되는 반면, 자연스럽게 이중 결합은 이중선으로 표시됩니다. 도트는 때때로 원자 옆에 그려져 결합되지 않은 전자의 존재를 나타내고, 한 쌍의 점은 과도한 전자를 나타냅니다.
공명 구조는 분자가 가질 수있는 가능한 다른 루이스 구조입니다. 분자에 대한 공식 전하를 계산하면 분자의 올바른 구조 일 가능성이 높은 공명 구조를 결정할 수 있으며 가장 올바른 것으로 간주되는 루이스 구조는 분자 전체에 고르게 분포 된 공식 전하를 갖는 구조입니다. 공식 전하를 공명 구조와 관련하여 공식적인 전하를 결정할 때 공식 전하의 모든 합은 분자의 총 전하와 동일해야합니다.
공식 요금 요약 :
공식 전하는 분자 내의 원자의 전기 전하로 정의 될 수 있으며, 총자 전자의 총 수를 분자가 아닌 전자의 수를 공유 결합에 위치한 총 전자의 절반을 결정함으로써 계산 될 수있다. 공식 전하를 사용하여 분자에서 전하의 분포를 추정 할 수 있습니다.
NO3 질산염에 대한 사실
질산염은 질산으로 구성된 염이며, 에스테르뿐만 아니라 다른 알코올은 때때로 질산이라고도합니다. 질산염 이온은 분자 질량이 63이며, 정확히 3 개의 동일한 산소 원자와 연결된 하나의 질소 원자로 구성됩니다. 질산염은 질산이 아닌 아 질산으로 만든 소금 인 아질산염과 다릅니다. 니트로 기능성 그룹을 함유하는 유기 화합물을 니트로 화합물로 지칭한다. 질산염 이온은 상당히 위험하고 독성이있을 수 있으며 질산염 독성 과정을 통해 인간에게 영향을 미칩니다. 혈액의 헤모글로빈에서 발견되는 철 원자가 산화되어 산소를 운반 할 수없는 상태입니다.
.
질산염은 대규모 퇴적물, 특히 아질의 퇴적물에서 일반적으로 발견됩니다. 이 아질성 퇴적물은 칠레 소금물로도 알려진 질산나트륨의 주요 글꼴 역할을합니다. 아질산염은 박테리아에 의해 만들어 졌으며이 박테리아가 생산하는 질산염 화합물은 역사적으로 화약에 사용되었으며 발효에 의해 생성되었습니다. 질산염은 생분해 성 특성과 높은 용해도로 인해 비료에 사용됩니다. 1 차 질산염 비료에는 칼슘 염, 칼륨, 암모늄 및 나트륨이 포함됩니다. 질산은 또한 수증기와 이산화 질소 사이의 상호 작용으로 인해 번개 타격 동안 생성됩니다.
NO3의 공식 요금은 얼마입니까?
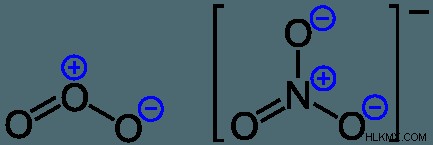
NO3의 루이스 표현은 질소 원자가 중심에 있고 3 개의 산소 원자에 의해 궤도에 달하는 방식으로 정렬된다. 질소는 산소 이중 결합에서 2 개, 각 N - O 결합에서 1 개의 결합 전자를 갖기 때문에 양전하가 있습니다. 전자의 내부 코어는 전기 중립에 필요한 7 개 대신 6 개의 전자와 관련이 있습니다.
질소 원자에는 총 6 개의 전자가 있기 때문에 공식적인 양전하가 있습니다. 이중 결합이있는 산소는 공유되거나 8 개의 전자를 소유하므로 중립으로 간주됩니다. 마지막으로, 단일 결합 산소 원자는 9 개의 전자와 연결되어 있으며 전반적으로 음전하가 있습니다. 이것은 질산염 이온의 전체 전하가 -1입니다.
이것을 다른 방식으로두기 위해, 각 산소 원자는 내부 쉘 내에 2 개의 전자와 원자의 두 번째 쉘 내에 6 개의 전자를 갖는다. 산소는 두 번째 쉘에 최대 8 개의 전자를위한 공간이 있습니다. 3 개의 산소 원자는 6 개의 전자를 갖기를 원합니다. 한편, 질소는 총 7 개의 전자, 두 번째 쉘에서 5 개, 내부 쉘에 2 개의 전자를 가지고 있습니다. 산소와 마찬가지로 질소는 두 번째 껍질에 더 많은 전자를위한 공간이 있습니다. 특히 3 개가 더 많은 공간이 있습니다.
질소의 외부 껍질에는 5 개의 전자가 있기 때문에이 5 개의 전자를 뿌려 내부 껍질에 2 개의 전자 만 있으면 질소를 만족시킬 수 있습니다. 이것은 나트륨 원자가 염소 원자와 상호 작용할 때 종종 발생합니다. 나트륨 원자는 외부 껍질에서 염소로 단일 전자를 기증하며, 이는 테이블 소금을 형성합니다.
이것은 질소가 산소 원자가 질소의 핵보다 질소의 외부 전자를 더 많이 당기기 때문에 5 개의 외부 쉘 전자를 주변의 산소 원자에 기증 할 것임을 의미합니다. 이것은 질소 원자가 5 개의 전자를 흘리게 될 것이지만, 3 개의 산소 원자는 총 6 개의 전자를 원한다. 따라서 여전히 마지막 전자에 대한 욕구가있을 것입니다. 질산 나트륨이 질산 나트륨과 결합하여 질산 나트륨 또는 나노 3을 형성 할 때와 같이 질산염이 다른 분자와 결합되는 경우, 나트륨의 외부 껍질에서 발견되는 단일 전자는 N03으로 전달되어 질산염 이온으로 만들어 -1 전하를 갖습니다.
.






