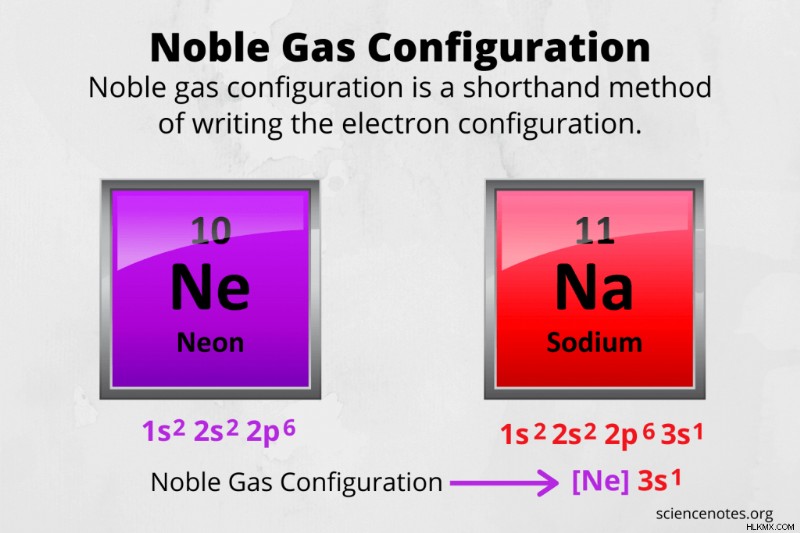
화학에서 고귀한 가스 구성 원자의 전자 구성을 작성하는 속기 방법입니다. 고귀한 가스 구성을 사용하는 이유는 전체 전자 구성이 원자가 높은 원자에 대해 매우 길어지기 때문입니다.
다음은 고귀한 가스 구성을 작성하는 방법과 모든 118 요소에 대한 전자 구성 목록입니다.
고귀한 가스 구성을 쓰는 방법
고귀한 가스 구성은 주기성 테이블의 요소 앞에 발생하는 고귀한 가스 코어와 원자의 원자가 전자의 전자 구성을 제공합니다. 그러나 원자가 전자 수를 찾기 위해 전체 전자 구성을 작성하는 방법을 이해해야합니다.
고귀한 가스 구성을 작성하는 단계는 다음과 같습니다.
- 원자의 전자 수를 찾으십시오. 중립 원자의 경우 원자 번호와 동일합니다. (이온의 경우, 전자의 수는 양성자 수와 같지 않지만 동일한 단계가 적용됩니다.)
- 전자 껍질과 에너지 레벨을 전자로 채우십시오.
각 S 쉘은 최대 2 개의 전자를 보유합니다.
각 P 쉘은 최대 6 개의 전자를 유지합니다.
각 D 쉘은 최대 10 개의 전자를 보유합니다.
각 F 쉘은 최대 14 개의 전자를 보유합니다.
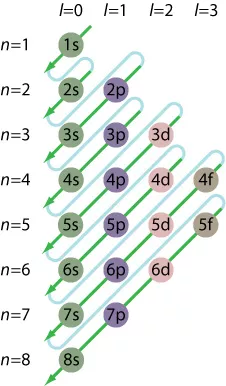
- Aufbau 규칙을 따르고 전체 전자 구성을 작성하십시오. Aufbau 원리는 전자가 더 높은 에너지 수준에 추가하기 전에 낮은 에너지 수준을 채 웁니다. Brute Force를 사용하여 구성을 작성할 수 있지만 다이어그램을 그리고 대각선을 따르는 것이 더 쉽습니다.
1s
2s 2p
3S 3P 3D
4S 4P 4D 4F
5S 5P 5D 5F
6S 6P 6d
7S 7p
8s
궤도가 겹치므로 껍질을 순차적으로 채우지 마십시오 (1, 2, 3, 4,…). 대신 Madelung의 규칙을 사용하십시오.
1s <2s <2p <3s <3p <4s <3d <4p <4d <4d <5p <6s <4f <5d <6p <7s <5f <6d <7p
참고 :Madelung의 규칙은 특히 무거운 전이 금속 중 일부와 관련하여 어려운 규칙이 아닙니다. 상대 론적 영향이 작용하고 순서를 바꿉니다.
- 주기성 테이블의 요소 앞에 고귀한 가스를 찾으십시오. 고귀한 가스 코어를 작성한 다음 원자가 전자를 작성하여 고귀한 가스 구성을 작성하십시오. 고귀한 가스 코어는 괄호로 둘러싸인 고귀한 가스 요소 기호입니다 :[He], [ne], [ar], [kr], [xe] 또는 [rn]. 원자가 전자는 쉘을 채우지 않거나 옥트 규칙 (고귀한 가스 제외) 또는 18- 전자 규칙 (전이 금속)을 만족시키는 "남은"전자입니다. 그것들을 식별하는 두 가지 쉬운 방법이 있습니다. 원자가 전자는 고귀한 가스 전자 구성을지나 남은 전자입니다. 그들은 또한 요소 그룹의 특징입니다. 예를 들어, 알칼리 금속에는 항상 1 개의 원자가 전자가 있습니다.
고귀한 가스 구성 예
예를 들어, 나트륨의 고귀한 가스 구성을 작성하십시오.
- 원자의 나트륨 수는 11이므로 중성 원자에는 11 개의 양성자와 11 개의 전자가 있음을 알고 있습니다.
- Aufbau 원리를 사용하여 전자 쉘을 채우면 1S 2S SP 3S 구성이 제공됩니다. 슈퍼 스크립트를 추가하고 올바른 수의 전자가 있는지 확인하십시오.
- 고귀한 가스 구성을 작성하십시오. 주기율표를 보면 나트륨이 네온이되기 전에 고귀한 가스를 기록하십시오. 네온의 전자 구성은 1S 2S 2p입니다. 따라서 고귀한 가스 코어 기호 [NE]는 나트륨 전자 구성의 해당 부분을 대체합니다. 나트륨의 고귀한 가스 구성은 [ne] 3s. 입니다
예를 들어, Neon의 고귀한 가스 구성을 작성하십시오.
- 네온은 고귀한 가스이지만, [NE]를 쓰고 그것을 좋다고 부르는 것보다 더 잘할 수 있습니다. 먼저 주기율표를 사용하고 네온 원자의 전자 수는 10입니다.
- Aufbau 원리를 따르고 전자 쉘을 채우십시오 :1S 2S 2P
- 주기성 테이블의 Neon 이전의 고귀한 가스 코어를 사용하여 고귀한 가스 구성을 작성한 다음 원자가 전자를 작성하십시오. 네온의 고귀한 가스 구성은 [He] 2s 2p입니다. 네온의 원자가는 8 (2s 쉘의 2 개의 전자와 2p 쉘에 6 개의 전자)이라는 점에 주목하십시오.
모든 118 요소에 대한 고귀한 가스 구성 목록
| 번호 | 요소 | 전자 구성 |
| 1 | 수소 | 1s |
| 2 | 헬륨 | 1s |
| 3 | 리튬 | [he] 2s |
| 4 | 베릴륨 | [he] 2s |
| 5 | 붕소 | [he] 2s2p |
| 6 | 탄소 | [he] 2s2p |
| 7 | 질소 | [he] 2s2p |
| 8 | 산소 | [he] 2s2p |
| 9 | 불소 | [he] 2s2p |
| 10 | 네온 | [he] 2s2p |
| 11 | 나트륨 | [ne] 3s |
| 12 | 마그네슘 | [ne] 3s |
| 13 | 알루미늄 | [ne] 3s3p |
| 14 | 실리콘 | [ne] 3s3p |
| 15 | 인 | [ne] 3s3p |
| 16 | 황 | [ne] 3s3p |
| 17 | 염소 | [ne] 3s3p |
| 18 | 아르곤 | [ne] 3s3p |
| 19 | 칼륨 | [ar] 4s |
| 20 | 칼슘 | [ar] 4s |
| 21 | 스칸디움 | [ar] 3d4s |
| 22 | 티타늄 | [ar] 3d4s |
| 23 | Vanadium | [ar] 3d4s |
| 24 | 크롬 | [ar] 3d4s |
| 25 | 망간 | [ar] 3d4s |
| 26 | 철 | [ar] 3d4s |
| 27 | 코발트 | [ar] 3d4s |
| 28 | 니켈 | [ar] 3d4s |
| 29 | 구리 | [ar] 3d4s |
| 30 | 아연 | [ar] 3d4s |
| 31 | 갈륨 | [ar] 3d4s4p |
| 32 | 게르마늄 | [ar] 3d4s4p |
| 33 | arsenic | [ar] 3d4s4p |
| 34 | 셀레늄 | [ar] 3d4s4p |
| 35 | Bromine | [ar] 3d4s4p |
| 36 | 크립톤 | [ar] 3d4s4p |
| 37 | Rubidium | [kr] 5s |
| 38 | strontium | [kr] 5s |
| 39 | yttrium | [kr] 4d5s |
| 40 | 지르코늄 | [kr] 4d5s |
| 41 | niobium | [kr] 4d5s |
| 42 | Molybdenum | [kr] 4d5s |
| 43 | Technetium | [kr] 4d5s |
| 44 | Ruthenium | [kr] 4d5s |
| 45 | Rhodium | [kr] 4d5s |
| 46 | Palladium | [kr] 4d |
| 47 | 은 | [kr] 4d5s |
| 48 | 카드뮴 | [kr] 4d5s |
| 49 | indium | [kr] 4d5s5p |
| 50 | tin | [kr] 4d5s5p |
| 51 | 안티몬 | [kr] 4d5s5p |
| 52 | 텔루 리움 | [kr] 4d5s5p |
| 53 | 요오드 | [kr] 4d5s5p |
| 54 | Xenon | [kr] 4d5s5p |
| 55 | 세움 | [xe] 6s |
| 56 | 바륨 | [xe] 6s |
| 57 | 란타늄 | [xe] 5d6s |
| 58 | Cerium | [xe] 4f5d6s |
| 59 | praseodymium | [xe] 4f6s |
| 60 | Neodymium | [xe] 4f6s |
| 61 | promethium | [xe] 4f6s |
| 62 | 사마 리움 | [xe] 4f6s |
| 63 | Europium | [xe] 4f6s |
| 64 | 가돌리늄 | [xe] 4f5d6s |
| 65 | Terbium | [xe] 4f6s |
| 66 | dysprosium | [xe] 4f6s |
| 67 | holmium | [xe] 4f6s |
| 68 | erbium | [xe] 4f6s |
| 69 | thulium | [xe] 4f6s |
| 70 | ytterbium | [xe] 4f6s |
| 71 | lutetium | [xe] 4f5d6s |
| 72 | hafnium | [xe] 4f5d6s |
| 73 | tantalum | [xe] 4f5d6s |
| 74 | 텅스텐 | [xe] 4f5d6s |
| 75 | rhenium | [xe] 4f5d6s |
| 76 | osmium | [xe] 4f5d6s |
| 77 | iridium | [xe] 4f5d6s |
| 78 | 플래티넘 | [xe] 4f5d6s |
| 79 | 골드 | [xe] 4f5d6s |
| 80 | 머큐리 | [xe] 4f5d6s |
| 81 | 탈 리움 | [xe] 4f5d6s6p |
| 82 | 리드 | [xe] 4f5d6s6p |
| 83 | Bismuth | [xe] 4f5d6s6p |
| 84 | 폴로늄 | [xe] 4f5d6s6p |
| 85 | 아스타틴 | [xe] 4f5d6s6p |
| 86 | 라돈 | [xe] 4f5d6s6p |
| 87 | Francium | [rn] 7s |
| 88 | 라듐 | [rn] 7s |
| 89 | actinium | [rn] 6d7s |
| 90 | Thorium | [rn] 6d7s |
| 91 | protactinium | [rn] 5f6d7s |
| 92 | 우라늄 | [rn] 5f6d7s |
| 93 | neptunium | [rn] 5f6d7s |
| 94 | Plutonium | [rn] 5f7s |
| 95 | Americium | [rn] 5f7s |
| 96 | curium | [rn] 5f6d7s |
| 97 | Berkelium | [rn] 5f7s |
| 98 | 캘리포니아 | [rn] 5f7s |
| 99 | 아인슈타이늄 | [rn] 5f7s |
| 100 | fermium | [rn] 5f7s |
| 101 | mendelevium | [rn] 5f7s |
| 102 | 노벨륨 | [rn] 5f7s |
| 103 | 로렌 시움 | [rn] 5f7s7p |
| 104 | Rutherfordium | [rn] 5f6d7s |
| 105 | dubnium | *[rn] 5f6d7s |
| 106 | Seaborgium | *[rn] 5f6d7s |
| 107 | Bohrium | *[rn] 5f6d7s |
| 108 | Hassium | *[rn] 5f6d7s |
| 109 | meitnerium | *[rn] 5f6d7s |
| 110 | darmstadium | *[rn] 5f6d7s |
| 111 | roentgenium | *[rn] 5f6d7s |
| 112 | 코페르늄 | *[rn] 5f6d7s |
| 113 | nihonium | *[rn] 5f6d7s7p |
| 114 | flerovium | *[rn] 5f6d7s7p |
| 115 | Moscovium | *[rn] 5f6d7s7p |
| 116 | livermorium | *[rn] 5f6d7s7p |
| 117 | 테네신 | *[rn] 5f6d7s7p |
| 118 | Oganesson | *[rn] 5f6d7s7p |