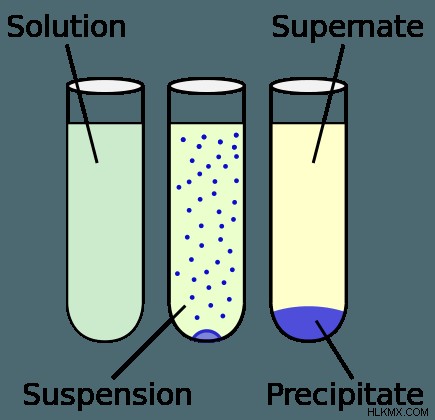
용질 및 용액이 결합 될 때 발생할 수있는 세 가지 결과가 있으며, 희석 용액, 포화 용액 또는 침전물이있을 수 있습니다. 용해도 규칙 화학 물질의 용해도에 대한 일반적인 지침은 이온 고체를 용매와 혼합 할 가능성을 예측하는 데 도움이 될 수 있습니다.
용해도 가란 무엇입니까?
용해도의 화학적 특성은 특정 물질의 용매 내에서 용해되는 능력을 나타냅니다. 용매는 평형에서 용매 대 용량 비율로 측정되거나, 즉, 평형에서 용매 내에 얼마나 많은 용질이 존재하는지에 따라 측정된다. 용물이 용매에 용해되는 것은 포화 용액으로 알려진 것입니다.
에탄올 및 물과 같은 일부 물질은 올바른 용매와 결합 될 때 가능한 모든 비율이 용해됩니다. 모든 비율에 용해되는 것은 오해로 알려져 있습니다. 특정 조건에서 발생할 수있는 용액의 평형 용해도가 초과되는 경우, 용액은 과포화되어 있으며 본질적으로 주목할만한 것으로 알려져 있습니다. 메타 안정성은 최소 에너지 또는지면 상태를 벗어난 화학/동적 시스템의 상태를 말합니다.
솔루션이 올바른 온도에있는 용액과 같은 과포화되기 위해서는 특정 조건이 필요합니다. 화학 시스템이 더워지면 더욱 용해되는 경향이 있으며, 그 결과 더 많은 용질을 용해시킬 수 있습니다. 다양한 물질 상태는 온도 변화에 다르게 반응합니다.
용해도에 영향을 미치는 요인
대부분의 고체 물질은 온도가 증가함에 따라 용해도가 증가하지만 이것은 보편적으로 사실이 아닙니다. 액체 물이 매우 높은 온도에있을 때, 임계 온도에 접근하는 온도는 고온에서의 물의 특성 변화로 인해 이온 용질 용질이 덜 용해됩니다. 용질이 기체 형태 일 때 온도 증가와의 상호 작용을 예측하기가 어렵습니다. 그러나 일반적으로, 가스는 고온에서 유기 용매와 결합 될 때 가스가 더욱 용해되며 온도가 증가함에 따라 물에 덜 용해됩니다.
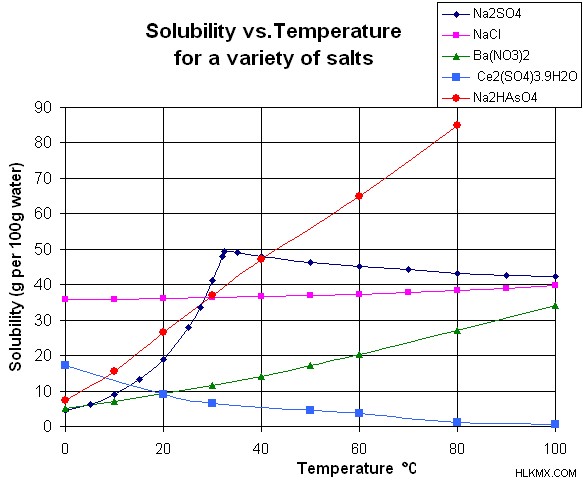
물질의 용해도에 영향을 미치는 또 다른 요인은 압력입니다. 용해도에 대한 압력의 영향은 온도만큼 크지 않으므로 자주 중요하지 않은 것으로 취급됩니다. 그러나 압력이 감소함에 따라 용해도가 눈에 띄게 감소하는 것을 보는 황산 칼슘과 같은 물질을 다룰 때 중요한 고려 사항입니다.
용매는 일반적으로 고체 또는 액체이지만 항상 그런 것은 아닙니다. 용매는 혼합물 또는 순수한 물질 일 수있다. 용매가 용해되는 시스템, 용질은 고체, 액체 또는 가스 일 수 있습니다. 화학 물질이 용해되지 않으면 불용성이라고합니다. 이 용어는 때때로 쉽게 용해되지 않는 화합물에도 적용됩니다. 전혀 용해되지 않는 화합물이 거의 없습니다.
용해
용해도가 용질 내에서 용해되는 물질 능력을 지칭하는 경우, 용매로 용해되는 실제 과정을 용해라고합니다. 용해는 공유 화학 물질과 관련하여 일반적으로 상당히 간단합니다. 에탄올과 같은 공유 화학 물질은 물에 용해 될 때 새로운 수소 결합을 만듭니다. 대조적으로, 이온 성 화합물의 용해는 더 복잡 할 수있다. 염화나트륨 및 다른 이온 성 화합물은 물과 결합 될 때 별도의 이온으로 용해됩니다. 이 분리 된 이온은 본질적으로 물 분자의 코트를 얻고 그들에게 싸여있다. 염화나트륨 이온이 에탄올 용해처럼 용해되지 않는다는 사실에도 불구하고, 염화나트륨은 여전히 수용성으로 간주됩니다. 용매가 결정질 염화나트륨을 증발시킬 때 결과적으로 남겨 져 있기 때문입니다.
.
물질이 다른 물질에 얼마나 용해 될 가능성을 결정할 때, 휴리스틱“용해와 같은 것”을 사용할 수 있습니다. 이것은 용질과 결합 된 용질과 유사한 화학적 구조를 갖는 용매가 용지가 가장 잘 고체된다는 일반적인 규칙을 말합니다. 이것은 단지 휴리스틱 일 뿐이며이 규칙에는 예외가 있습니다.
.용해도 측정 측면에서, 물질의 용해도는 종종 농도로 주어진다. 형식은 용매 킬로그램 당 x 용질 또는 용매 100ml 당 x입니다.
물은 특정 고형물을 용해시킨다
자당은 차와 커피와 같은 음료를 달게하는 데 사용하는 설탕입니다. 자당의 탄소, 수소 및 산소는 분자간 힘에 의해 함께 결합되지만,이 힘은 상당히 약합니다. 설탕이 물에 배치되면 분자를 함께 유지하는 결합이 쉽게 파열되어 설탕을 물에 용해시킵니다. 즉, 이들 C12H22O11 분자는 용액으로 방출됩니다.
수 크로스 내의 분자들 사이의 결합을 파괴하려면 에너지가 필요하며, 물의 산소-하이드로겐 결합을 분해하기 위해 에너지가 필요합니다. 수 크로스 분자가 용액에 맞추기 위해서는 물의 수소 결합을 방해해야합니다. 용매와 용질 사이에 약한 결합이 있으며, 이는 용매와 용질의 구조를 방해하는 데 필요한 에너지를 보충 할 수 있습니다. 설탕과 물 메쉬가 함께 잘 어울릴 정도로 1 리터의 물이 1800g의 자당을 용해시킬 수 있습니다.
염, 이온 성분은 음성 및 양의 이온을 함유 할 수 있습니다. 이들 이온은 반대 전하를 갖는 입자들 사이의 인력에 의해 서로 연결된다. 고형물이 물로 녹 으면서 이온이 용액으로 방출됩니다. 결과적으로, 이온은 극성 용매 분자와 관련이있다. 일반적으로, 소금은 물에 용해 될 때 분리되어 이온으로 분해됩니다. 이온 성 화합물은 물에 용해 될 수 있으며 이온과 물 분자의 상호 작용은 염의 이온 결합을 분리하는 데 필요한 에너지를 보상하기에 충분한 에너지를 생성합니다. 또한, 물 분자를 분해하는 데 필요한 에너지 (염분을 용액으로 가져올 수 있도록)도 보상해야합니다.
평형 및 용해도
시간이 지남에 따라 이온 농도의 변화가 없을 때 화학 반응은 평형 상태입니다. 시스템이 평형 지점에 도달하면 용액을 포화 용액이라고합니다. 용액은 평형의 용질과 공존 할 수있는 최대 양의 이온을 갖기 때문에 포화 용액이라고합니다. 용액이 포화되고 타격 평형이되기 위해 주어진 양의 용액에 첨가되어야하는 용질의 양을 용해도라고합니다.
용해도 규칙
용질과 솔루션이 결합 될 때 발생할 수있는 세 가지 결과가 있습니다. 용질의 용해도와 용질의 양이 정확히 같으면 결과는 포화 용액입니다. 그러나 용해 될 수있는 양보다 용질이 적은 경우 (화학 물질의 용해도) 희석 용액으로 간주됩니다. 마지막으로, 과도한 용질이 결정될 때 침전물이 형성됩니다. 이것은 해결 될 수있는 것보다 더 많은 용질이있을 때 발생하여 나머지 용질이 다른 용액에서 분리됩니다.
.용해도 규칙은 가장 자주 발견 된 고체의 용해도에 대한 지침입니다.
규칙 1 :리튬, 칼륨, 나트륨, 세슘 및 루비듐과 같은 그룹 I 요소의 이온으로 구성된 다양한 염은 일반적으로 몇 가지 예외가있는 가용성입니다. 또한 가용성은 암모늄 이온을 함유 한 염입니다.
규칙 2 :질산염 이온이있는 소금은 일반적으로 용해됩니다.
규칙 3 :염소, 브롬 또는 요오드의 음이온을 함유하는 염은 일반적으로 용해됩니다. 이 규칙에 대한 예외에는 Ag+, PB2+및 (HG2) 2+로 만든 것과 같은 Halide Salts가 포함됩니다.
규칙 4 :은 소금은 일반적으로 불용성입니다. 이 규칙에 대한 주목할만한 예외에는 Ag (C2H3O2) 및 AgNO3가 포함됩니다.
규칙 5 :황산염 염은 가용성이며, BASO4, PBSO4, CASO4, SRSO4 및 AG2SO4와 같은 몇 가지 예외가 있습니다.
규칙 6 :수산화염은 다소 용해되는 경향이 있으며,이를 포함하는 요소 그룹에 따라 다른 수준의 용해도를 나타냅니다. 그룹 1 수산화물 염은 가용성이며, 그룹 2 수산화물 염은 약간 가용성 일뿐입니다. 전이 금속 수산화물 염과 Al3+ 수산화 염분은 불용성입니다.
규칙 7 :전이 금속으로 만든 황화물은 AG2S, ZNS, CD 및 FES를 포함하여 불용성입니다. 황화 납, 비소, 안티몬 및 비스무트 납도 불용성 본성을 가지고 있습니다.
규칙 8 :탄산염은 일반적으로 BACO3, SRCO3 및 CACO3과 같은 그룹 2 탄산염을 포함하여 불용성입니다. PBCO3 및 FECO3도 불용성입니다.
규칙 9 :크로메이트, 음이온은 PBCRO4 및 BACRO4와 같은 산소 및 크롬을 포함하는 전형적으로 불용성입니다.
규칙 10 :AG3PO4 및 CA3 (PO4) 2와 같은 인산염은 일반적으로 불용성입니다.
규칙 11 :PBF2, MGF2 및 BAF2와 같은 물질에서 볼 수 있듯이 가루는 일반적으로 불용성입니다.