단백질은 신체에서 수많은 기능을 수행하는 유기 거대 분자입니다. 단백질의 단량체 (개별 단위)를 아미노산 이라고합니다 . 대부분의 아미노산은 수소 (H), 탄소 (C), 산소 (O) 및 질소 (N)로 구성됩니다. 물 외에도, 단백질의 형태로 아미노산은 대부분의 인간 조직의 대부분을 구성합니다. 인체에는 극성, 모양 및 부착 된 기능 그룹과 관련하여 분류 된 500 개가 넘는 알려진 아미노산이 있습니다. 인체에서, 아민 및 카르 복실 그룹을 갖는 아미노산이 특히 중요하다. 단백질은 인체에서 엄청난 기능을 수행하므로이를 구성하는 아미노산은 우리가 알고있는 삶에 필요합니다.
단백질로 아미노산의 대기업은 유전자 발현의 최종 생성물이다. 단백질 생성에 대한 지침은 단일 DNA 세그먼트에 포함 된 뉴클레오티드 염기의 서열에서 암호화된다. RNA는 mRNA 형태로 DNA로 인코딩 된 이러한 지시를 전사합니다. mRNA의 가닥은 코돈, 3-베이스 세그먼트를 함유하며, 여기서 3 개의 염기의 각 그룹은 특정 아미노산과 일치한다. TRNA는 상응하는 염기 세그먼트에 결합하여 지정된 아미노산과 함께 운반합니다. 아미노산은 폴리펩티드 스탠드를 형성하기 위해 함께 묶여있다. 본격적인 단백질을 만들기 위해 함께 묶인 몇몇 폴리펩티드 가닥.
단백질의 기본 단위 인 것 외에도 아미노산 자체는 중요한 생물학적 역할을합니다. 글루타메이트 및 감마-아미노 부티르산 (GABA)과 같은 아미노산은 뇌에서 뉴런의 발사를 조절하는 반면, 프롤린과 글리신과 같은 다른 사람들은 생물학적 구조와 하위 구조의 성분입니다.
아미노산 :기본
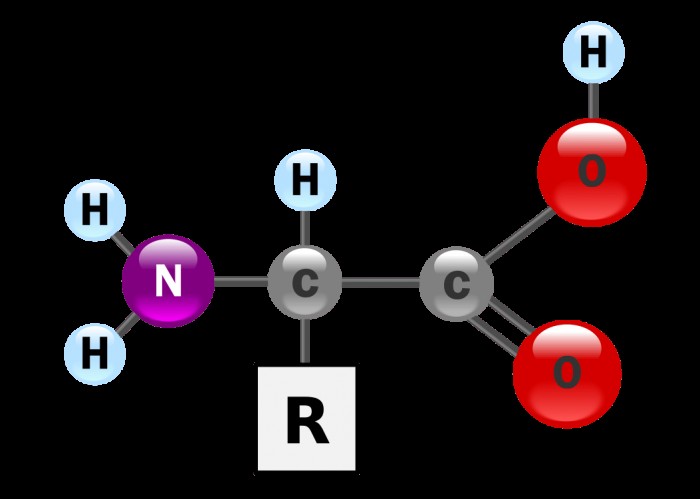
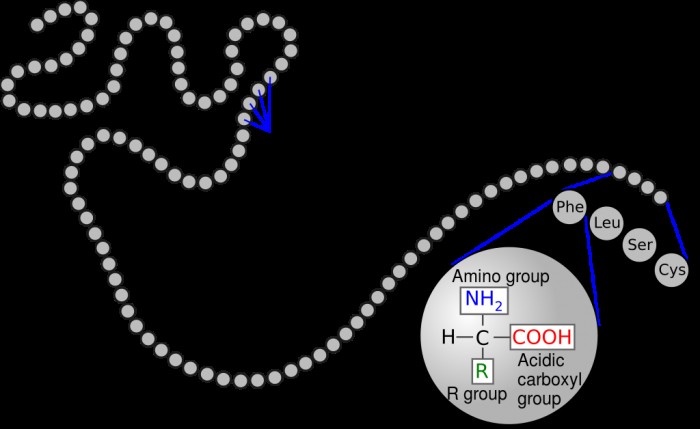
아미노산은 아미노기에 결합 된 중심 탄소 원자로 구성된 공통 구조를 갖는다 (NH 2 ) 및 카르 복실 그룹 (COOH). 생체 내에서, 아미노산은 일반적으로 산성 용액에 존재하며, 여기서 탈 양성자 화 된 산성 용액, 각 그룹은 수소를 잃고 양전하가있다.
"R"은 결합 된 측쇄를 나타냅니다.이 측쇄는 각 종류의 아미노산에 고유 한 부분입니다. 특정 R 사슬은 아미노산의 동일성을 결정합니다. R 그룹이 수소 인 경우 글리신입니다. 그것이 벤젠 고리라면 페닐알라닌입니다. 측쇄의 특성은 용해도, 산도, 극성 및 산화제 또는 감속기인지와 같은 전체 아미노산의 많은 물리적 특성을 결정합니다.
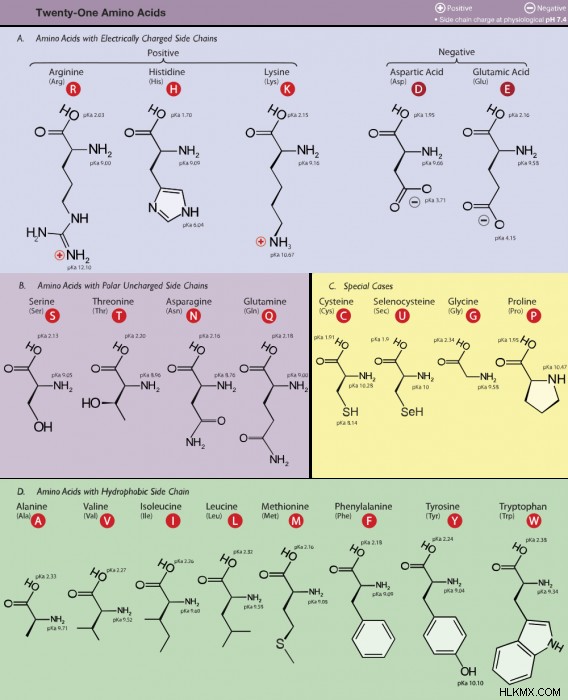
500 개가 넘는 알려진 아미노산이 있지만, 인간 DNA는 약 20에 대한 코드 만 코딩합니다.이 20 개의 아미노산은 실제로 단백질을 만드는 것입니다. 다양한 다른 아미노산이 합성되며 단백질 제작 외부에 사용됩니다.
이 20 개의 아미노산 중에서, 인체는 신체의 기존 화합물을 사용하여 9를 합성 할 수 없습니다. 이 9 개의 "필수"아미노산은 외부 공급원에서 소비되어야합니다. 9 가지 필수 아미노산은 페닐알라닌, 발린, 트레오닌, 트립토판, 메티오닌, 류신, 이소류신, 라이신 및 히스티딘
입니다아미노산은 어떻게 단백질을 만드는가?
단백질은 폴리펩티드의 사슬이며, 연결된 아미노산으로 만들어졌습니다. 아미노산은 펩티드 결합이라고하는 공유 결합을 통해 인접 아미노산에 연결된다. 펩티드 결합은 하나의 아미노산 결합의 카르 복실 그룹이 다른 아민 그룹의 아민 그룹과 함께 발생할 때 발생한다. 반응은 단일의 물 분자를 제거하고 탄소와 질소 사이의 공유 결합을 초래합니다.
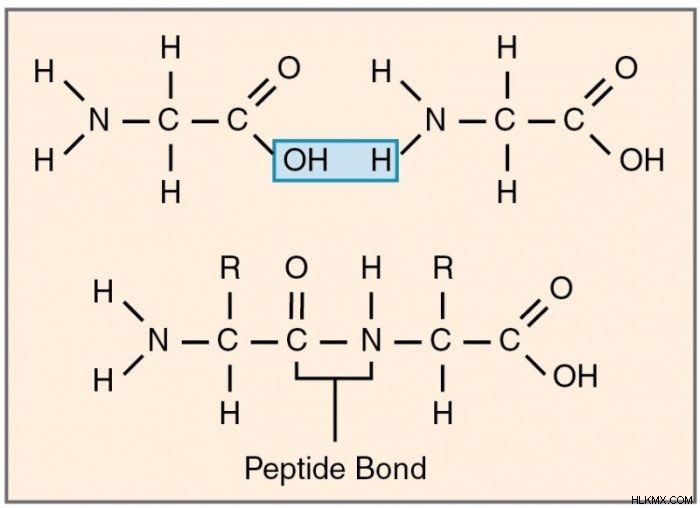
아미노산은 기하학적으로 비대칭이기 때문에, 폴리펩티드 사슬은 방향을 갖는다. 한쪽 끝은 질소베이스 아민 그룹에서 종료되고 다른 쪽은 탄소 기반 카르복실기에서 끝납니다.
아미노산은 RNA 번역 과정에서 폴리펩티드 가닥으로 물리적으로 조립된다. 번역 동안, 전사 된 mRNA 결합은 리보솜에 결합한다. TRNA라고 불리는 다른 RNA 분자는 상보적인 뉴클레오티드 염기-쌍을 통해 mRNA에 부착된다. TRNA 분자는 mRNA 코돈에 의해 지정된 아미노산을 운반한다. 예를 들어, mRNA 코돈이 'AUG'인 경우 상응하는 TRNA 염기 쌍은 'TAC'이며 아미노산 메티오닌을 지정합니다. 마찬가지로, 코돈 UGG는 아미노산 트립토판을 암호화한다. TRNA는 아미노산을 서로 옆에 배치하는 mRNA에 결합하여 펩티드 결합을 형성하고 폴리펩티드 사슬을 생성한다.
일반적으로, 구조 후, 폴리펩티드 체인은 번역 후 변형을 겪고, 여기서 그룹이 추가 될 수 있거나 특정 서열이 다른 서열에 약간 수정된다.
.단백질의 구조
각 단백질은 포함하는 아미노산 서열에 의해 고유하게 지정된다. 이들 아미노산의 순서는 단백질의 기능에 영향을 미친다. DNA의 변화는 발현 된 아미노산 서열의 변화를 초래할 수 있으며, 이는 관련 단백질의 기능에 영향을 미칩니다. 예를 들어, 겸상 적혈구 빈혈과 관련된 증상은 헤모글로빈을 지정하는 아미노산 서열의 한 가지 차이로 인한 것입니다. 6 번째 자리를 차지하는 글루탐산은 발린으로 대체됩니다. 결과적으로 생성 된 헤모글로빈 단백질은 실 모양의 모양이 길다는 것입니다. 모양과 같은 실은 혈액 세포의 모양을 변화시켜 세포벽에 달라 붙어 혈류를 손상시킵니다.
아미노산의 서열 외에도 1 차 구조 이라고 불리는 , 단백질은 2 차 구조를 갖는다 이는 펩티드 사슬 골격의 기하 주름을 나타냅니다. 인체에는 α- 헬릭스와 β- 기울기 시트라고 불리는 두 가지 주요 종류의 2 차 구조가 있습니다.
α- 나선 구조에서, 펩티드 사슬은 코일 뱀처럼 그 자체로 비틀어진다. 하나의 아미노산의 카르 보닐기는 아민 그룹 4 스팟에 수소 결합된다. 생성 된 구조는 수소 결합에 의해 함께 유지되는 단단히 코일 된 나선이다. 반면에, β- 유사 시트는 이웃 아미노산의 아민과 카르 보닐기 사이의 수소 결합에 의해 함께 고정 된 폴리펩티드의 선형 사슬로 구성된다. 일부 아미노산은 β- 유추 시트보다 α- 나선 구조를 형성 할 가능성이 높으며 그 반대도 마찬가지입니다.
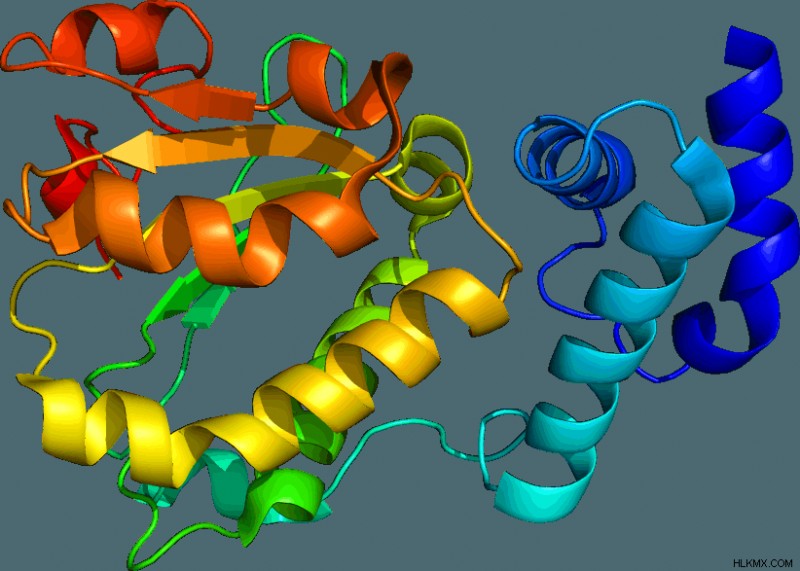
마지막으로, 단백질은 3 차 3 차원 구조를 갖는다 구조. 3 차 구조는 전체 단백질의 3 차원 기하학이며 R 측쇄의 상호 작용에 의해 결정된다. R 사슬은 거의 알려진 모든 비공유 결합을 통해 상호 작용합니다. R 그룹이 소수성 또는 친수성인지 여부는 단백질의 방향에 영향을 미칩니다.
많은 단백질은 단일 폴리펩티드 사슬로 구성되지만 일부는 서로 대기하는 여러 폴리펩티드 사슬로 만들어집니다. 이러한 종류의 폴리펩티드 사슬 단백질은 Quaternary를 갖는다 구조, 각 3 구조의 상호 작용에 의해 결정되는 구조. 헤모글로빈은 각각 α 및 β 구조 각각 4 폴리펩티드 사슬 2로 구성된 단백질 중 하나입니다.
단백질은 모양을 유지하기 위해 특정 pH 값과 온도가 필요합니다. pH 값의 온도가 너무 높거나 낮아지면 단백질을 함께 유지하는 분자간 상호 작용이 파괴 될 수 있고 단백질이 풀려 형태를 잃게됩니다. 방출 된 단백질은 "변성 된"단백질이라고하며 더 이상 그들의 기능을 수행 할 수 없습니다. 예를 들어, 열이 뇌의 단백질을 변성하여 기능을 방해하고 기능하지 못하게 할 수 있기 때문에 매우 높은 열은 위험합니다.
아미노산의 다른 용도
단백질을 구성하지 않는 다른 아미노산은 중요한 생물학적 역할을합니다. 눈에 띄는 예 중 하나는 감마-아미노 부티르산 (GABA)입니다. GABA는 신경 학적 기능에 중요한 아미노산입니다. 뇌의 GABA는 뉴런을 두뇌로 인한 행동 전위의 발사를 조절하는 주요 신경 전달 물질입니다. 구체적으로, GABA- 매개 억제는 뇌에서 뉴런을 약화시켜 발사를 방지하는 부정적인 피드백 과정이다. GABA는 축삭의 구조에 결합하여 칼륨 및 나트륨 이온의 흐름을 조절하여 행동 전위의 발사를 조절했다. GABA는 또한 포유 동물의 근육 톤을 조절하는 책임이 있습니다.
아미노산은 또한 세로토닌, 도파민, 에피네프린 및 뉴클레오티드와 같은 다른 중요한 생물학적 분자의 전구체로서 작용한다.
요약하면, 아미노산은 단백질의 단량체이다. 아미노산은 아민 및 카르복실기에 부착 된 중심 탄소 원자로 구성되어 측쇄에 결합된다. 결합 된 측쇄의 특성은 아미노산의 특정 동일성과 그 결합 거동을 결정합니다.
RNA 번역 과정에서, 아미노산 서열은 DNA의 관련 섹션에서 인코딩 된 정보에 기초하여 함께 조각된다. 아미노산은 그들의 아민과 카르 복실 그룹 사이에 공유 결합을 형성하여 폴리펩티드 가닥이라고 불리는 긴 사슬을 형성한다. 폴리펩티드 가닥은 적절한 구조로 접어 완전 신생 단백질을 형성합니다. 경우에 따라, 다수의 폴리펩티드 가닥은 서로 연결되어 다수의 폴리펩티드 가닥의 복잡한 단백질을 생성한다. 단백질의 정확한 동일성 및 관련 기능은 정확한 아미노산 서열에 의해 결정된다. 이 순서의 변화는 단백질의 기능에 변화를 가져올 수 있습니다. 모양을 잃는 단백질은 변성되어 일반적으로 더 이상 기능적이지 않습니다.