충전 알루미늄 이온 일반적으로 3+입니다. 요소의 원자 번호는 13이기 때문에 13 개의 전자와 13 개의 양성자가 있다는 사실을 반영합니다. 알루미늄의 원자가 껍질에는 3 개의 전자가 있으며, 옥셋 규칙에 따라,이 3 개의 전자는 손실되어 10 개의 전자와 13 개의 양성자가 생깁니다. 알루미늄은 3 개의 과도한 양성자를 가지므로 염기 알루미늄 이온의 전하는 3+입니다.
알루미늄 요금이 3+ 인 방법에 대한 빠른 답변입니다. 그러나 이온, 이온화 및 다른 요소 사이의 관계를 더 잘 이해하려면 양성 이온과 음성 이온을 자세히 살펴 보는 것이 필요합니다.
알루미늄에 대한사실
알루미늄은주기적인 요소 테이블의 붕소 그룹의 부드러운 금속입니다. 그것은 "al"기호로 표시되며 원자 번호 13을 가지고 있습니다. 알루미늄은 매우 풍부한 요소입니다. 실제로 지구의 지각에서 가장 풍부한 금속 요소입니다. 철과 함께 알루미늄은 가장 일반적으로 사용되는 금속입니다. 2016 년에 알루미늄의 글로벌 생산은 약 5,900 만 톤이었습니다. 알루미늄은 차량, 배터리 및 포장재 생성, 건물 건설 및 요리기구 생성을 포함하여 다양한 목적으로 사용됩니다.
원자의 구조
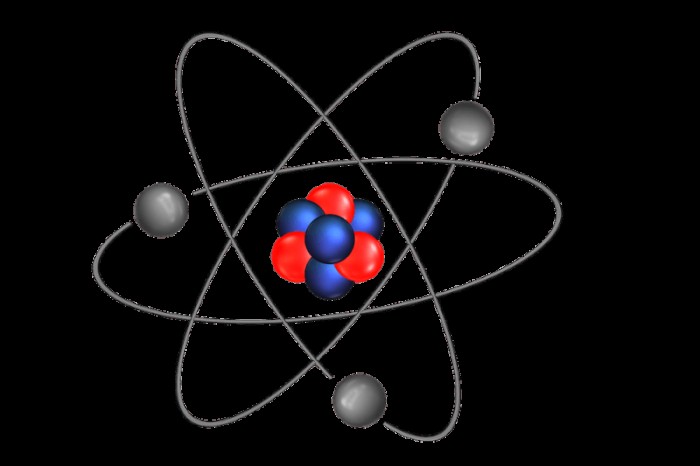
원자는 세 가지 기본 부품으로 만들어졌으며 두 개의 별개의 영역으로 분리됩니다. 중성자, 전자 및 양성자는 원자의 세 가지 구성 부분입니다. 양성자는 양 아 원자 입자이며, 중성자는 전하가없는 아 원자 입자입니다. 중성자와 양성자는 대략 같은 질량을 가지고 있습니다. 중성자 무게는 약 1.67 x 10 그램입니다.
원자의 첫 번째 영역은 원자의 중심 인 핵입니다. 핵은 중성자와 양성자로 구성됩니다. 핵 외부에는 핵을 공전하는 전자로 구성된 궤도 영역이 있습니다. 원자의 가장 바깥 부분을 전자 쉘이라고합니다. 이 전자 껍질은 전자를 궤도에 담고 원자는 여러 전자 쉘을 가질 수 있습니다.
원자는 간단한 구성 입자가 어떻게 배열되는지에 따라 다른 특성을 갖는다. 요소의 원자 수는 해당 요소의 원자가 가지고있는 양성자의 수를 기반으로합니다. 원소의 원자가 중립 인 경우, 동일한 수의 전자와 양성자가 있음을 의미합니다. 요소가 한 중성자의 수는 해당 요소의 동위 원소를 정의합니다. 동위 원소는 단순히 프라임 요소의 원자의 변형이며, 원자에 의해 보유한 중성자의 수에서만 다릅니다.
종합하면 요소의 질량 수는 요소의 원자에서 양성자와 중성자의 수에 의해 결정됩니다. 요소의 동위 원소는 중성자 수가 다르기 때문에 약간 다른 질량 숫자를 가지고 있습니다. 원소의 원자 질량은 요소의 다른 동위 원소에 대한 질량 수의 평균을 취함으로써 식별됩니다. 동위 원소는 핵에서 다른 수의 중성자로 인해 다른 원소의 형태이지만, 이온은 원소의 기본 원자가 하나 이상의 전자를 얻거나 손실했기 때문에 순 전하를 갖는 원자입니다.
이온의 정의
이온은 원자가 껍질로부터 하나 이상의 전자를 잃거나 얻은 분자 또는 원자이며, 결국 순 음성 또는 양전하 전하를 제공합니다. 다른 방법으로 말하면, 이온은 화학 종에 불균형 수의 전자와 양성자를 가지고 있습니다. ION이라는 용어는 처음에 영국 화학자 Michael Faraday에 의해 만들어졌으며 한 전극에서 다른 전극으로 이동하는 화학 물질을 설명했습니다.
음성 및 양성 이온
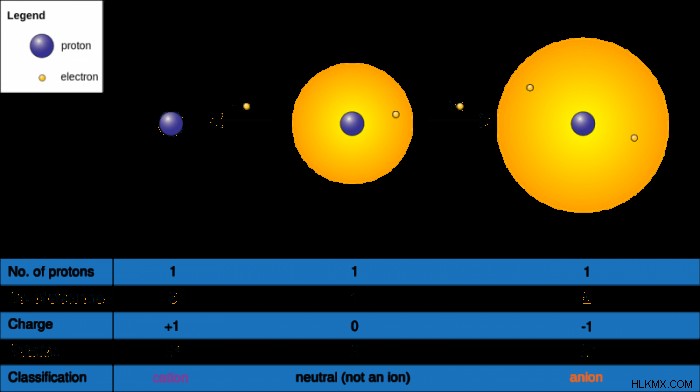
순수한 원자에는 전하가 없으며 이는 원자가 같은 수의 전자와 양성자를 가지고 있기 때문입니다. 전자는 음전하를 갖는 반면 양성자는 양전하의 아 원자 입자이다. 그러나, 특정 상황과 화학적 상호 작용은 원자가 전자를 흘리거나 전자를 얻게하여 순 전하에 영향을 미칠 수있다. 이 경우, 순 전하에 영향을받는 원자는 이온이됩니다.
예를 들어, 알루미늄 원자는 원자가 13을 가지며, 이는 13 개의 양성자가 있다는 사실을 반영합니다. 모든 양성자는 양전하를 가지며, 대부분의 원자는 중립이기 때문에 모든 양성자에 대해 전자가 있고 13 개의 전자와 13 개의 양성자가 있음을 따릅니다. 이것은 알루미늄의 모든 원자에 해당됩니다. 금속은 전자를 잃어 이온을 형성 할 수 있으며, 이것은 3 개의 전자를 잃을 수있는 알루미늄의 경우에 해당됩니다.
충전 변경의 결과가 양의 이온을 생성하는 경우, 이온은 양이온이라고합니다. 양이온은 그것들을 포함하는 요소로 표시 되므로이 경우 알루미늄 양이온이 있습니다.
알루미늄의 특정 예에서, 알루미늄은 13 개의 전자와 13 개의 양성자 덕분에 초기 전하를 가졌다. 알루미늄 원자가 이온이되면 3 개의 전자가 떨어집니다. 전자가 10 개 밖에 없기 때문에, 그 값은 양성자 수에서 빼고 차이는 양의 3입니다. 따라서, 알루미늄의 이온은 3+로 표시된 3의 양전하를 갖는다. 일부 화학 책은 숫자 이후가 아닌 숫자 앞에 "+"기호를 넣을 수 있습니다. 알루미늄의 양이온 버전은 플러스 부호와 슈퍼 스크립트 번호로 표시 될 수 있습니다 :al 또는 al.
음으로 하전 된 이온의 경우,이를 음이온으로 지칭합니다. 음이온은 전하 변화의 결과로 전반적으로 음전하를 남깁니다. 예상 한 바와 같이, 음이온의 표현은 양이온의 양의 부호 대신 음의 부호를 갖는다. 예를 들어, Cl-는 염소가 다른 전자를 집어 올 때 생성 된 염소 음이온이며, 이는 -1의 순 전하를 제공합니다. 각각의 요소의 양이온이라고 불리는 양이온과 달리 음이온은 특수한 명명 체계를 가지고 있습니다 (따라서 염소의 음이온은 염소 이온으로 지칭되지 않습니다).
이온이 단일 원소로 만들어지면, 이것은 접미사 "-ide"를 원소의 이름에 추가하여 표시되므로 염소 음이온은 염화물이되고, 탄소와 질소 또는 Cn-의 이온이 시안화물이됩니다. 대부분의 경우 "-ide"접미사로 충분합니다. 그러나, 하나 이상의 원소로 만들어진 이온 (다 원자 음이온이라고 함) 또는 산소를 함유하는 음이온이있는 경우 더 많은 접미사 및 접두사가 필요합니다. 접미사 "-ate"는 전형적인 수의 산소 원자를 갖는 옥시 아니 네니언에 적용됩니다. 한편, 접미사 "-라이트"는 표준보다 산소가 하나 줄인 옥시 아니 네니언에 적용됩니다.
표준보다 2 개의 산소가 적지 만 최소한의 전하를 갖는 옥시 아니 네니언의 경우, 요소베이스는 "-hypo"접두사의 중간에 추가됩니다. 한편, 하나의 산소 원자를 표준보다 더 많이 가지고 있지만 여전히 정상 전하를 갖는 옥시 아니 네니언의 경우, 포당 당은“-ate”접미사뿐만 아니라 그에도 추가됩니다. 마지막으로, 산소에 대한 황 치환을 갖는 음이온에는 접두사“thio-”.
가 주어집니다.
다른 요소는 여러 가지 다른 방식으로 이온을 일으킬 수 있습니다. 그러나 이러한 많은 요소가 가족으로 그룹화 될 수 있기 때문에 (주기율표에서 발견되는 그룹 또는 열이 주어지면) 이러한 요소가 이온을 만드는 방식이 예측할 수 있습니다. 이온의 생성을 예측하는 데 몇 가지 휴리스틱이 사용될 수 있습니다.
일반적으로, 주기율표 중 하나에서 발견되는 알칼리 금속은 이온화 할 때 1+ 이온을 만듭니다. 예를 들어, Li+는 리튬 이온입니다. 주기율표의 그룹 2에서 발견되는 알칼리성 지구 금속은 2+ 양이온으로 이온화됩니다. 베릴륨은 2+ 이온을 만듭니다. 대부분의 금속은 주기적 표의 그룹 3, 예를 들어 인듐, 갈륨 및 알루미늄 이온화하여 3+ 양이온을 형성합니다. 위에서 볼 수 있듯이 알루미늄 양이온은 Al 3+로 정의됩니다. 그룹 6 메탈 로이드 및 산소, 텔 루륨, 셀레늄 및 황과 같은 비금속은 이온화 될 때 2 개의 음이온을 생성합니다. 예를 들어, 안정적인 이온화 된 산소 상태는 O2-로 주어진다. 주기율표의 그룹 7에서 발견 된 요소는 이온화 할 때 -1의 음이온을 생성합니다. 이러한 이유로 불소의 음이온은 fl-.
로 제공됩니다.즉, 순수한 금속, 즉 비 회전 금속은 항상 양이온이나 양의 이온을 형성하게됩니다. 실제로, 금속의 정의 특성 중 하나는 금속이 전자를 흘리는 경향이 있다는 것입니다. 대조적으로, 전이 금속 또는 금속성은 다양한 전하 강도를 갖는 이온을 형성 할 수 있으며,이 양이온이 형성되는 수많은 방법을 분류하는 것은 순수한 금속보다 더 복잡하다.
.금속은 일반적으로 양이온을 형성하지만 비금속은 일반적으로 전자를 얻고 음이온을 형성합니다. 금속이 전자를 잃는 방법과 마찬가지로 비금속의 정의 특성은 종종 전자를 얻는다는 것입니다. 이러한 금속과 비금속이 전자를 얻거나 잃는 이유는 여러 가지 복잡한 요인과 관련이 있습니다. 원소의 이온화에 영향을 미치는 요인 중 일부는 원자가가 가진 원자가 전자의 수와 옥트 규칙 화학 결합을 포함합니다.
.