Co 2 의 대기 수준 지구의 역사상 그 어느 때보 다 극적으로 증가하고 있으며, 2100 년까지 거의 600 ppm에 도달 할 수 있다는 예측. , 주로 화석 기반 시스템에서 비롯된 것은 지구 온난화, 빙하 절제, 해양 산성화, 해수면 상승 및 종의 멸종과 같은 기후와 환경에 돌이킬 수없는 파괴적인 영향을 미칩니다.
이러한 부작용을 완화하기 위해 정부는 파리 협약을 체결하여 대기 CO 2 를 줄이려고 시도했습니다. 집중. 그러나 2016 년에 MIT는 파리 협약이 제공 한 목표를 2100 년에 온도 증가 결과를 예측하기 위해 현재의 통합 글로벌 시스템 모델링 (IGSM)을 사용하여 현재 상황에서 미래에 충족 될 수 없다고 결론지었습니다. 즉, 배출 감소와 제거 Co
Co 2 열 화학적, 전기 화학적, 광화학, 방사 화학 및 생화학 적 반응과 같은 다양한 방식을 통해 전환 될 수 있습니다. 이들 방법 중, 전기 촉매 Co <서브> 2 재생 가능 에너지 시스템과의 프로세스와의 호환성을 고려할 때 환경 영향을 최소화하는 관점에서 감소는 특히 매력적입니다. 이 과정은 지속 가능하고 저탄소 발자국 화학을 허용합니다. 이 과정과 관련된 많은 이점이 있습니다 :1) 반응은 실온 및 압력 및 중성 pH에서 수행 될 수 있습니다. 2) H2를 공급하지 않고 진행될 수 있지만, H2가 물 전기 분해에 의해 현장에서 생성되는 곳; 3) 간헐적 전기를 안정적인 화학 에너지로 변환하고 귀중한 제품을 생성합니다. 4) 제품 분포는 외부 파라미터 (예 :전기 촉매, 전해질, 반응 온도 및 적용된 전압)를 조정하여 조정할 수 있습니다.
CO 2 변환 연료 또는 상품 화학 물질로 화학 물질은 오늘날의 "화석 연비"에서 지속 가능한 "co 2 로 에너지 전환을 희망합니다. 경제." 최종 생성물은 일산화탄소, 포르 테이트, 메탄, 에틸렌, 에탄올 등을 포함하여 최대 20 개까지입니다. c 1 에 상대 제품, c 2+ (2 개 이상의 탄소 원자를 함유하는) 탄화수소 및 산소는 에너지 밀도가 더 높다. 또한 많은 다수의 다수의 제품은 수요가 높은 화학 공급 원료입니다.
그러나 효율적인 Co
공동 양성자-전자 (H/E)를 용액에서 흡착 된 종으로 전달함으로써, Co 2 분자는 카르 복실 중간체 *COOH로 감소시킨 다음 *CO 및 물 분자로 환원된다. *CO는 다른 제품의 생산을위한 일반적인 중간체로 제안됩니다. c 2+의 경우 *CO 중간체의 제품은 두 가지 다른 반응 메커니즘이 있습니다.
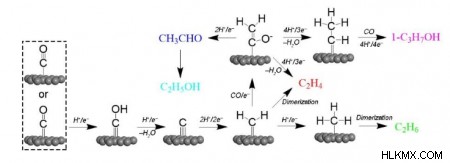
"카르 벤"메커니즘에서 *CO는 *C로 변환 할 수있는 양성자 및 전자와 결합하여 *ch 2 로 변환 될 수있다. . c 2+ 생성물은 *ch 2 의 비 전자 화학적 커플 링을 통해 생성됩니다 *ch 2 의 모이어 티 또는 피셔-트로프 스와 같은 조합 및도 1에 도시 된 바와 같이, CO (CO 삽입) 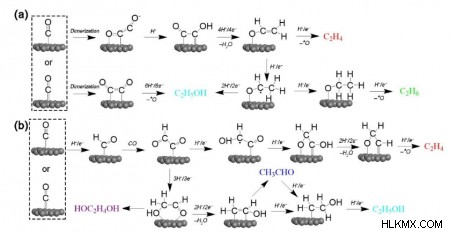
다른 주요 경로는 c 2+에 대해보고되었습니다 생성물 생성에는 *CO 이량 체화가 포함되며, 낮은 과도한 수용에서 C-C 커플 링을위한 핵심 단계입니다. *CO 이량 체화 *C 2 o 2 -(속도 제한 단계) H 2 를 사용하여 Eley-Rideal (ER) 메커니즘을 통해 *co-coh로 빠르게 수화됩니다. o + e (h 2 o ad ) (그림 2a). *CO-COH는 비닐 알코올로 감소됩니다 (*CH 2 =Cho), 선택성 결정 중간체. 이어서, 경로는 에틸렌 형성, 에탄 형성 및 에탄올 형성 경로로 분기된다. 때때로, *선택은 *c 2 보다 더 안정적 일 것으로 예상됩니다. o 2- . 이로 인해 *CO를 *CHO로 감소시킨 다음 *CO와 반응하여 *COCHO *CO 이량 체화 및 후속 감소보다 더 유리합니다 (그림 2B). *Cocho는 에틸렌과 에탄올 사이의 선택성을 결정하는 데 핵심입니다. *Cochoh의 형성은 에틸렌으로 이어지고 *ch 2 Choh는 에탄올을 형성합니다.
c 2+의 형성을 촉진합니다 c 1 에 대한 화합물 제품 및 H 2 , 우리는 흡착 에너지를 조작하고 c 2+의 표면 커버리지를 조작하려고 시도해야합니다. 중간체. *CO, *COH, *CoCO와 같은 주요 반응 중간체의 최대화 및 안정화 (결합 에너지의 최적화)는 표면 변형, 구조 튜닝 및 시너지 효과/협력적인 다중 활성 부위를 갖춘 탠덤 시스템 생성을 통해 향상되어야합니다. 효소 촉매에서 영감을 얻은 3 차원 (3D) 활성 부위의 구조는 스케일링 관계 제한을 깨뜨릴 수 있습니다. 3D 다공성 공간에서 근접한 뚜렷한 활성 센터는 상이한 중간체 부위에 결합하여 c 2+를 촉진 할 수있다. 제품 생성.