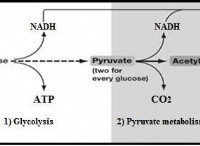
열역학의 첫 번째 법칙에 따르면 시스템의 내부 에너지 (ΔU)의 변화는 시스템에 제공된 열의 양과 같습니다 (Q)은 시스템 (w) 에 의해 수행 된 작업의 양을 뺀 것과 같습니다.
램프를 켜면 어떻게됩니까? 와이어를 통해 오는 전기 에너지는 빛으로 변환됩니다. 차량의 점화를 크랭크 할 때 휘발유에 저장된 에너지는 당신을 움직입니다. 음식에서 먹는 칼로리로 인해 발생하는 모든 일상 활동. 에너지는 항상 한 형태에서 다른 형태로 변환됩니다! 우리는 그것이 의식적인 삶의 모든 순간에 일어나는 것을 본다.
물리학의 영역에는 세상에서 일어나는 모든 일에 대한 법이 있습니다. 이 현상을 지배하는 법은 에너지 보존 법입니다. 법은 에너지가 창조되거나 파괴 될 수 없다고 말합니다. 한 형태에서 다른 형태로만 변경할 수 있습니다.
열역학은 열 에너지 및 작업 및 기타 형태의 에너지와의 관계를 다루는 물리학의 분야입니다. 열역학의 첫 번째 법칙은 열 에너지와 관련된 에너지 보존 법칙의 버전입니다. 열역학 법칙은 작업, 열 및 에너지가 시스템에 어떤 영향을 미치는지 정의합니다. 시스템은 에너지가 전달되는 우주의 모든 지역입니다. 이 경계 외부의 모든 것은 주변 환경입니다.
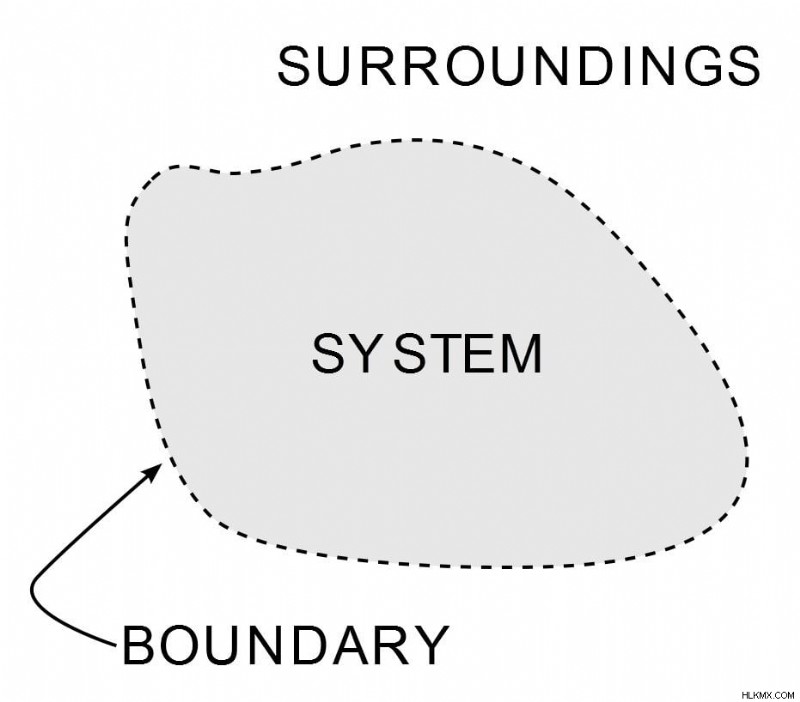
(사진 크레딧 :Wavesmikey / Wikipedia Commons)
열역학의 첫 번째 법칙은 무엇입니까?
열역학의 첫 번째 법칙은 시스템의 내부 에너지의 변화를 나타냅니다 ( 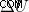 )는 시스템에 제공된 열의 양과 같습니다 (
)는 시스템에 제공된 열의 양과 같습니다 ( 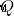 )에서 시스템에서 수행 한 작업의 양을 빼고 (
)에서 시스템에서 수행 한 작업의 양을 빼고 ( 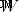 ) :
) :
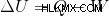
어떤 곳에서는 다음과 같이 찾을 수 있습니다.
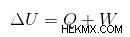 두 방정식의 차이점은 첫 번째 방정식에서 시스템에서 수행 된 반면 두 번째 방정식에서는 시스템에서 수행 된 작업이라는 것입니다. 시스템이 일부 작업을 수행하면 첫 번째 방정식을 사용할 수 있지만 시스템에서 작업이 수행되면 두 번째 방정식을 사용할 수 있습니다.
두 방정식의 차이점은 첫 번째 방정식에서 시스템에서 수행 된 반면 두 번째 방정식에서는 시스템에서 수행 된 작업이라는 것입니다. 시스템이 일부 작업을 수행하면 첫 번째 방정식을 사용할 수 있지만 시스템에서 작업이 수행되면 두 번째 방정식을 사용할 수 있습니다.
왜 다른 방정식이 있습니까?
법은 동일하게 유지되지만 방정식은 시스템에서 발생하는 사건에 따라 다릅니다. -W를 사용한 첫 번째 방정식은 내연 기관을 다루는 물리학 자에 의해 정의되었습니다. 그들의 경우, 시스템에 제공된 열은 가스를 팽창시켜 피스톤을 움직이거나“일부 작업을 수행”합니다. 그것은 법을 처음으로 전체 형태로 언급 한 과학자 인 Clausius가 사용한 방정식이었습니다.
화학자들은 가스에서 작업을 수행 할 때 프로세스가 발생하는 시스템을 대부분 처리하기 때문에 화학자는 주로 +W로 두 번째 방정식을 사용합니다. 이 방정식은 IUPAC 컨벤션의 일부이며 오늘날 가장 일반적으로 사용되는 방정식입니다.
열역학 제 1 법칙의 예
내연 기관

출처 :Wikimedia Commons/저자 :Michaelfrey
열역학의 첫 번째 법칙을 설명하는 데 사용되는 전형적인 예는 내연 기관입니다. IC 엔진에서 스파크 점화는 공기와 휘발유의 혼합물에 연소됩니다. 연소로 인해 엔진 내부의 가스가 팽창 해집니다. 이 팽창은 피스톤을 바깥쪽으로 밀어내어 차량을 앞으로 움직입니다. 이는 기계적 에너지입니다. 그 과정에서 엔진은 가열되어 열 에너지로 에너지를 잃어 버립니다.
우리가 이것을 방정식에 넣으면 내부 에너지의 변화 (또는 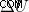 )는 연료에 저장된 에너지입니다. Q는 점화 플러그로 엔진에 제공된 열입니다. 따라서 w는 결과 운동 (기계적 에너지)과 열 (손실)입니다.
)는 연료에 저장된 에너지입니다. Q는 점화 플러그로 엔진에 제공된 열입니다. 따라서 w는 결과 운동 (기계적 에너지)과 열 (손실)입니다.
녹는 얼음 큐브

(사진 크레디트 :Flickr)
아이스 큐브를 접시에 보관하고 그대로 두십시오. 몇 분 안에 물이 녹아 물로 전환됩니다. 얼음은 주변 공기에서 열을 흡수하고 공기가 시원해지고 얼음은 물로 변합니다. 이 경우, 열 흡수로 인해 물질의 상태가 바뀌고 있습니다. 내부 에너지 (또는 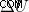 )는 주변 공기에서 에너지 (q)를 흡수함에 따라 증가하고 있습니다. 공정이 계속됨에 따라 물이 너무 오래 남아 있으면 물이 증기로 변합니다. 시스템 (물)의 내부 에너지는 주변 열이 함유 된 열에 개방되므로 계속 변화합니다. 따라서 열역학의 첫 번째 법칙은 에너지의 흐름을 지배합니다.
)는 주변 공기에서 에너지 (q)를 흡수함에 따라 증가하고 있습니다. 공정이 계속됨에 따라 물이 너무 오래 남아 있으면 물이 증기로 변합니다. 시스템 (물)의 내부 에너지는 주변 열이 함유 된 열에 개방되므로 계속 변화합니다. 따라서 열역학의 첫 번째 법칙은 에너지의 흐름을 지배합니다.