열역학의 제 2 법칙에 따르면 자발적인 과정에서 우주의 총 엔트로피는 항상 증가한다고합니다.
열 엔진이 100% 효율로 작동 할 수 있습니까? 1824 년에 열역학의 아버지로 알려진 과학자 Nicolas Léonard Sadi Carnot은 그 답을 찾으려고 노력했습니다. 그의 이론적 모델 중 하나에서, 그는 두 개의 열 저장소 사이에 피스톤이있는 실린더를 배치했습니다. 두 저수지는 일정한 온도에 있었지만 하나는 다른 온도보다 온도가 높았습니다.
아이디어는 두 저수지 사이의 열 흐름을 작업으로 변환하는 것이 었습니다. 그렇게하기 위해, 그는 저수지 사이에 피스톤이있는 실린더를 배치했습니다. 그러나 그는 100% 효율을 달성하는 것이 불가능하다는 것을 깨달았습니다. 일부 열은 항상 실린더를 통해 차가운 저수지로 흘러갔습니다.
열역학의 첫 번째 법칙은 에너지가 생성되거나 파괴 될 수 없다고 명시하고있다. 양식 만 변경할 수 있습니다. 그러나 특정 제한 사항이 있습니다. 그것은 변화가 일어날 수있는 방향을 정의하지 않으며, 변화가 가역적인지 아닌지는 알지 못합니다. 우리가 높이에서 물체를 떨어 뜨리면 잠재적 에너지가 운동 에너지로 변환되고 떨어집니다. 그러나 땅에 부딪친 후에는 같은 높이로 다시 튀지 않습니다. 그 이유는 무엇입니까? 이를 이해하려면 중요한 용어를 살펴 보겠습니다. 자발적 프로세스 .
자발적 프로세스
열역학의 자발적인 과정은 외부 개입없이 발생할 수있는 과정입니다. 또한 충분한 시간이 있어야합니다. 물 한 잔에 잉크 한 방울을 넣고 유리에“자발적으로”퍼지는 반면, 한 숟가락의 설탕은 물 한 잔에 녹기 위해 약간의 교반이 필요합니다. 외부에서 뜨거워지면 방으로 가열되면 방이 가열되지만 방을 차갑게 유지하려면 에어컨이 필요합니다.

잉크는 물에 자발적으로 퍼집니다
경험에 의해, 우리는 우리 삶에서 일어나는 일부 사건이 자발적이라는 것을 알고 있습니다. 그러나 과학자들은 모든 사건의 자발성을 정의하는 방법이 필요했습니다. 그들은 변화가 일어날 수있는 방향을 정의하는 방법이 필요했습니다. 이 필요성은 우리가 제 2 차 열역학 제 2 법칙 로 아는 것을 낳았습니다. .
열역학 제 2 법칙
열역학 법칙은 작업, 열 및 에너지가 주어진 시스템에 어떤 영향을 미치는지 정의합니다. 시스템은 에너지가 전달되는 우주의 모든 지역입니다. 이 경계 외부의 모든 것은 주변 환경으로 간주됩니다.
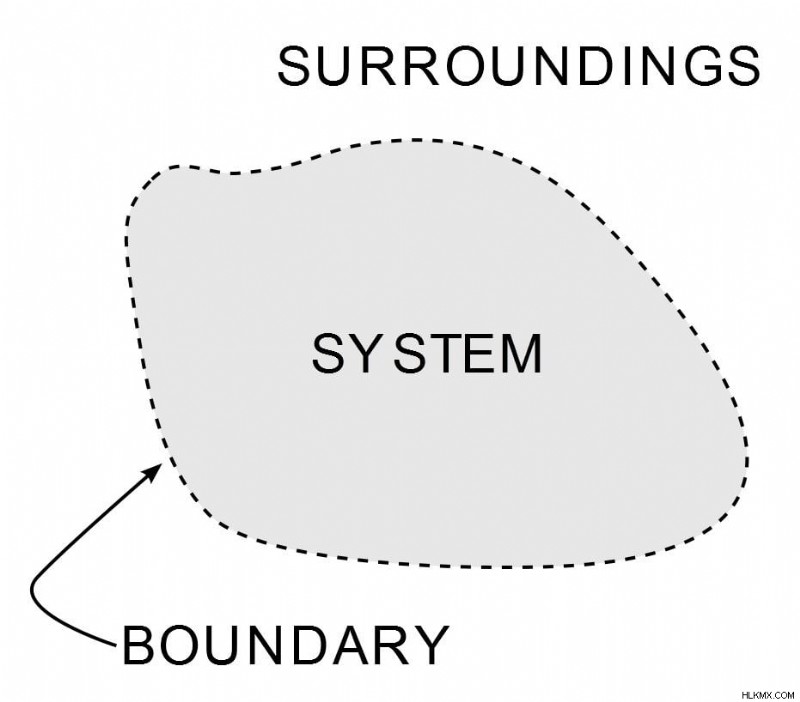
(사진 크레딧 :Wavesmikey / Wikipedia Commons)
열역학의 제 2 법칙에 따르면 자발적인 과정에서 우주의 총 엔트로피는 항상 증가한다고합니다. 또한 공식을 사용하여 정의됩니다.

여기서 S는 시스템의 엔트로피를 나타냅니다. 이 공식을 이해하려면 엔트로피라는 용어를 살펴 보겠습니다.
엔트로피
이 용어에 대해 들어 본 적이 있다면“장애”와 연관시킬 수 있습니다. 그러나 열역학에서는 정의가 더 진화됩니다.
엔트로피를 올바르게 이해하기 전에 에너지가 양자화되어 있음을 이해해야합니다. 원자의 전자가 에너지를 얻을 때, 그들은“양자”라고 불리는 소량의 에너지의 적분 배수로 만 흡수합니다.
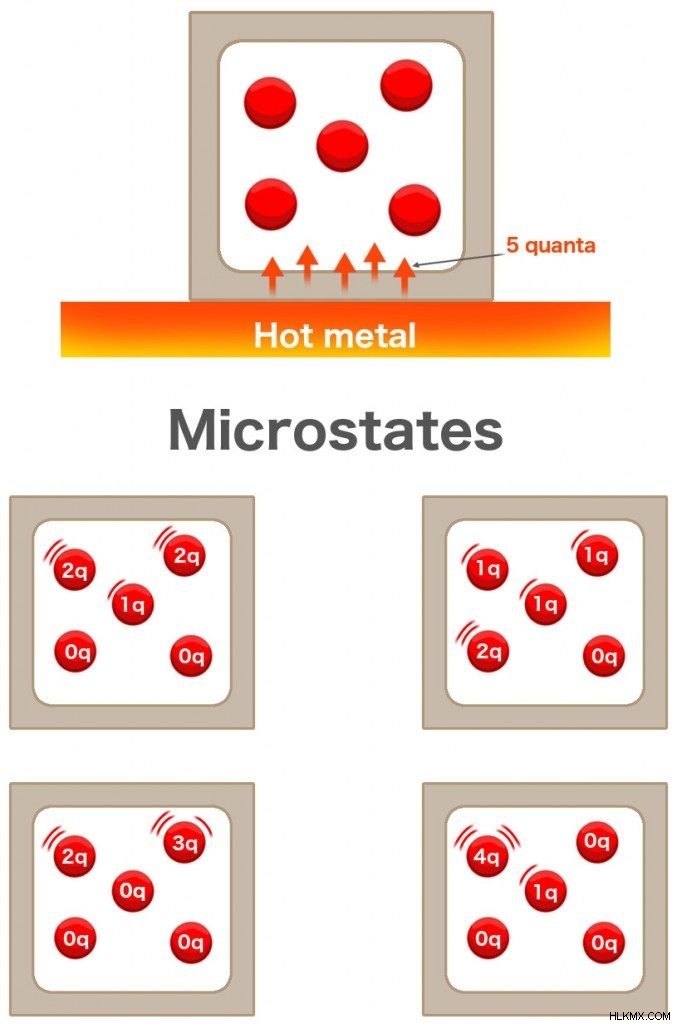
물 한 잔에 잉크 한 방울을 넣으면 물 전체에 퍼집니다. 마찬가지로, 뜨거운 금속이 테이블에 보관 된 경우, 그로 인한 열은 환경에 퍼집니다. 5 개의 분자 가스가 들어있는 상자가 있다고 상상해보십시오. 이 뜨거운 금속 바로 옆에 보관됩니다. 금속은 가스에 5의 Quanta를 전달합니다. 각 가스 분자는 각각 1의 양자 에너지를 얻을 수 있습니까? 반드시 그런 것은 아닙니다.

2 개의 분자는 각각 2 Quanta를 얻을 수 있고 하나의 분자는 1 Quantum을 얻는 반면, 다른 2 단위는 얻지 못할 수 있습니다. 한 분자는 3 Quanta, 다른 분자는 2를 얻을 수 있고 다른 분자는 2를 얻을 수 있고 다른 분자는 아무도 얻지 못할 수도 있습니다. 126 개의 가능한 조합이있을 수 있으며,이 조합은 공식을 사용하여 계산할 수 있습니다.
 여기, n은 분자의 수이고 Q는 에너지의 Quanta입니다.
여기, n은 분자의 수이고 Q는 에너지의 Quanta입니다.
이 분자들은 또한 서로 충돌하여 운동 에너지를 교환 할 수 있습니다. 그러나 총 에너지는 제공된 에너지의 양을 초과 할 수 없습니다.
이 조합을 각각 " microstate"라고합니다. 총 에너지 수준을 " macrostate"라고합니다. 엔트로피는 에너지가 모든 분자에 분포 될 수있는 방법의 수를 측정 한 것입니다. 따라서“ microstates 의 수의 요인입니다. ", ω.
로 표시됩니다
엔트로피는 상태 변수입니다. 상태 변수는 압력, 온도 및 부피와 같은 시스템의 물리적 상태를 설명하는 변수입니다. 엔트로피의 수학적 공식은 다음과 같습니다.
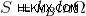
여기서 KB는 Boltzmann Constant입니다. 온도와 관련된 가스에서 입자의 평균 운동 에너지를 나타내는 물리적 상수입니다. 이 상수는 엔트로피를 계산하기 위해 마이크로 스테이트 수의 자연 로그에 곱합니다.
엔트로피의 변화는 또한 온도로 흡수 된 열을 나누어 계산할 수 있습니다. 열 흡수는 입자의 운동 에너지를 증가시킵니다. 따라서 공식은 다음과 같습니다.
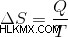
간단히 말해서, 엔트로피는 에너지를 시스템의 일련의 분자에 분배 할 수있는 방법의 수를 측정합니다.
.열 엔진의 엔트로피 계산
Carnot의 엔진으로 돌아가서 히트 엔진이 가능한시기를 파악 해 보겠습니다. 뜨거운 저수지의 온대가 Th의 온대와 차가운 저수지의 온도가 Tc의 온도를 가지고 있다고 가정 해 봅시다. QH 양의 열이 뜨거운 저수지에서 추출되어 일부 작업을 수행합니다.
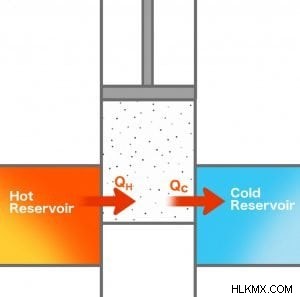
따라서 뜨거운 저수지의 엔트로피의 변화는 다음과 같습니다.
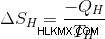
Q는 저장소에서 열이 추출되어 음수입니다
엔진의 피스톤이 작업을 수행하고 초기 상태로 돌아 오면 엔진 엔트로피의 변화 ( 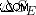 )는 0.
)는 0.
우리가 모든 에너지가 작업을 수행하기 위해 사용되고 차가운 저수지에 열이 주어지지 않는다고 가정하면 차가운 저수지의 엔트로피 ( 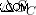 )도 0.
)도 0.
그래서, 
 우주의 총 엔트로피는 부정적이되어 자발적이 될 수 없습니다.
우주의 총 엔트로피는 부정적이되어 자발적이 될 수 없습니다.
이제 차가운 저수지가 QC의 열을 흡수하고 어떤 작업도 수행하는 데 익숙하지 않다고 가정 해 봅시다. 이 경우 차가운 저수지의 엔트로피 ( 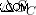 )
) 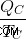
이 경우 
엔진이 작동 할 수있는 유일한 경우는 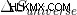 는 긍정적입니다
는 긍정적입니다 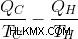 는 긍정적입니다.
는 긍정적입니다.
19 세기 후반, 켈빈 경과 맥스 플랑크 (Max Plank)는 이러한 관찰을했다. 그들은 다음과 같이 말했다. 이 진술은 또한 열역학 제 2의 법칙에 대한 대체 진술입니다.
Universal Law
Albert Einstein은 복잡한 열역학 언어에 매우 유창했습니다. 사실, 그는 주제에 관한 여러 논문을 출판했습니다. 그는 한 번 인용했다.“이론은 더욱 인상적이며, 구내의 단순성이 클수록, 다른 종류의 관련이 있으며, 적용 가능성의 영역이 더욱 확장 될수록 더욱 인상적입니다. 그러므로 고전적인 열역학이 나에게 만든 깊은 인상. 기본 개념의 적용 가능성의 틀 안에서 내가 확신하는 것은 보편적 인 내용의 유일한 물리적 이론입니다.”
.열역학의 두 번째 법칙은 우주를 주도합니다. 우리는 우주가 확장되고 있음을 알고 있습니다. 열역학 제 2 법칙에 따라 우주의 엔트로피도 증가해야합니다. 별은 우주의 에너지의 원천입니다. 마지막 별이 최종 광자를 방출 할 때까지 엔트로피 수준은 엄청나게 높아질 것입니다. 걱정하지 마십시오… 우리 모두는이 시간 전에 멸망했을 것입니다. 우주의 엔트로피를 증가시키기 위해 남은 에너지가 없어서 우주가 죽을 때입니다!
더 읽기 :
열역학의 첫 번째 법칙은 무엇입니까?
열역학의 세 번째 법칙은 무엇입니까?