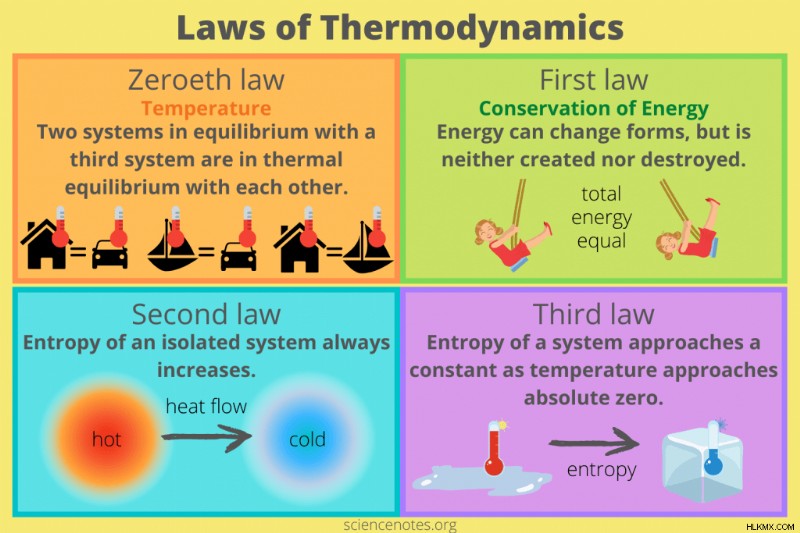
열역학은 에너지와 열에 대한 연구입니다. 열역학 법칙 물질과 에너지의 관계와 온도 및 엔트로피와의 관계를 설명하십시오. 많은 텍스트는 열역학의 세 가지 법칙을 나열하지만 실제로 4 가지 법칙이 있습니다 (제 4 법칙을 제로 로트 법이라고하지만)
다음은 열역학 법칙 목록과 각 법률의 의미에 대한 빠른 요약입니다.
열역학 법칙
열역학 법칙 온도의 개념을 설정합니다 :
두 시스템이 세 번째 시스템과 열 평형 상태 인 경우 서로 열 평형을 이루어야합니다.
예 : 자동차가 집과 같은 온도이고 자동차가 사무실과 같은 온도 인 경우, 집과 사무실은 서로 같은 온도입니다.
열역학의 첫 번째 법칙
열역학의 첫 번째 법칙 에너지 보존 법칙으로도 알려져 있습니다 . 그것은 시스템의 에너지가 형태를 바꿀 수 있지만, 그것은 생성되거나 파괴되지 않았다 . . 이 법을 진술하는 한 가지 방법은“아무것도 얻을 수 없습니다”입니다.
첫 번째 법칙을 진술하는 또 다른 방법은 시스템의 내부 에너지 (∆E)가 경계 (Q)의 열 흐름과 시스템에서 수행 된 작업 (w)입니다.
∆E =Q + W
예 :스윙에서 어린이의 에너지는 운동과 잠재적 에너지의 조합입니다. 시스템의 총 에너지는 아동이 스윙 아크 (최소 운동 에너지, 최대 잠재적 에너지), 아크의 바닥 (최대 운동 에너지, 최소 잠재적 에너지) 또는 그 사이의 어느 곳 에서나든 동일합니다.
열역학 제 2 법칙
열역학의 제 2 법칙 상태 열 평형이 아닌 시스템의 엔트로피가 증가합니다 . 엔트로피는 열역학적 시스템의 무작위성 또는 장애의 척도입니다. 엔트로피가 증가함에 따라 유용한 작업을위한 에너지가 적습니다. 첫 번째 법률에 아무것도 얻을 수없는 경우, 두 번째 법칙을“…
예 : 잠재적 에너지가 운동 에너지로 전환함에 따라 봄에 의해 구동되는 시계는 감소합니다. 그 후, 시계를 감아 시스템에 새로운 에너지를 추가 할 때까지 시계는 다시 실행되지 않습니다.
.예 : 시간이 지남에 따라 침실은 더 지저분하고 지저분 해집니다. 에너지를 소비하고 물건을 데리러 가면 더 깨끗해집니다.
열역학의 두 번째 법칙은 또한 시스템의 열 흐름 방향을 나타냅니다. 열 에너지는 더 높은 에너지에서 낮은 에너지로 흐릅니다.
열역학의 제 3 법칙
제 3의 법률은 시스템의 엔트로피가 온도가 절대적으로 접근함에 따라 일정한 값에 접근합니다 . 절대 0은 이론적으로 가능한 최저 온도입니다 (0K 또는 Zero Kelvin).
Absolute Zero에서 시스템의 엔트로피는 거의 입니다. 제로이지만 반드시 정확히 0은 아닙니다. 엔트로피는 시스템이 얼마나 많은 지상 상태인지에 따라 다릅니다. 순수한 결정질 물질은 완벽한 순서를 얻습니다. 최소지면 상태가 하나이며 절대 0에 엔트로피가 없습니다. 그러나 대부분의 물질은 절대로 엔트로피가 제로에 도달하지 않습니다.
영구 모션 머신은 불가능합니다
열역학 법칙의 한 가지 의미는 영구 운동 기계가 불가능하다는 것입니다. 에너지는 한 형태에서 다른 형태로 변할 수 있지만 엔트로피가 증가하고 약간의 사용 가능한 에너지가 손실됩니다. 기계는 결국 고갈 된 에너지 원으로 구동됩니다. 가장 가까운 사람들은 영원한 움직임에 도달 할 수있는 것은 의 초기 전원 공급 장치를 사용하는 것입니다. 초기 에너지 입력과 같은 태양열과 같은 끝없는.
참조
- Atkins, Peter (2007). 우주를 이끌어내는 4 가지 법 . OUP 옥스포드. ISBN 978-0199232369.
- 구겐하임, E.A. (1985). 열역학. 화학자 및 물리학자를위한 고급 치료 (7th ed.). 노스 홀랜드, 암스테르담. ISBN 0-444-86951-4.
- Kittel, C.; Kroemer, H. (1980). 열 물리학 (제 2 판). 샌프란시스코 :W.H. 자유민. ISBN 0-7167-1088-9.
- Wendt, Richard P. (1974). “전해질 용액을위한 단순화 된 전송 이론”. 화학 교육 저널 . 미국 화학 학회 (ACS). 51 (10) :646. doi :10.1021/ed051p646







