핵심 개념-충돌 이론
충돌 이론에 대한이 튜토리얼에서는 충돌을 성공적으로 만드는 이유에 대해 배울 것입니다. 또한 충돌 및 반응 속도를 높이는 방법과 충돌 이론의 중요성에 대해 배울 것입니다.
다른 기사에서 다루는 주제
동역학 분자 이론 이해
반응 속도 및 요율을 결정하는 방법
촉매 및 활성화 에너지
압력
정상 상태 근사치
충돌 이론을위한어휘
촉매 - 반응에 사용되지 않지만 활성화 에너지를 감소시키고 반응을 가속화하는 물질. 촉매에 대해 자세히 알아보십시오.
운동 에너지 - 모션으로 인한 물체의 에너지
활성화 에너지 - 반응하기 위해 반응물이 가지고 있어야하는 최소 에너지
동역학 - 반응 속도와 속도에 대한 연구
충돌 이론 소개
충돌 이론에 따르면 반응이 발생하기 위해서는 반응물이 올바르게 충돌해야합니다. 반응 속도는 충돌 빈도와 같습니다. 원자 충돌의 주파수는 가스와 정확히 계산 될 수 있기 때문에 충돌 이론은 가스로 제한됩니다. Max Trautz는 1916 년에 충돌 이론과 1918 년 독립적으로 윌리엄 루이스를 제안했습니다.
효과적인 충돌
효과적인 충돌은 화학 반응을 일으키는 것입니다. 효과적인 충돌 속도가 높을수록 반응 속도가 빨라집니다.
충돌이 화학적 변화를 일으키는 데 효과적이기 위해서는 충분한 에너지와 올바른 방향이 있어야합니다. 성공적인 충돌은 원자 사이의 결합을 방해하고 재 배열하기에 충분한 운동 에너지가 있어야합니다. 그렇지 않으면 공처럼 단순히 서로 튀어 나옵니다. 두 반응물 사이의 충돌 빈도는 반응물의 농도에 비례합니다. 예를 들어, 하나의 반응물의 농도를 두 배로 늘리면 충돌 수가 두 배가됩니다. 실온에서, 1 입방 센티미터의 가스는 1 초에 10 번의 충돌을 일으킨다. 그러나 이러한 모든 충돌이 성공하면 모든 반응이 1 초 안에 완료됩니다.
충돌의 방향은 반응의 분자가 더 복잡할수록 더욱 중요해진다. 예를 들어, n 2 사이의 반응에서 O 및 아니오, n < 2 의 산소 o 반응이 발생하기 위해서는 NO의 질소에 부딪쳐 야합니다. 분자가 복잡할수록 충돌의 수가 적을수록 반응에 대한 적절한 방향을 갖게됩니다.
요약하면, 충돌이 반응을 일으키는 데 효과적이기 위해 :
- 분자는 충돌해야합니다
- 충돌은 충분한 에너지 (활성화 에너지) 를 가져야합니다
- 분자는 적절한 방향을 가져야합니다
충돌 증가
충돌 횟수를 높이기 위해 조작 할 수있는 많은 요인이 있으며, 따라서 반응 속도가 있습니다. 이러한 요소 중 일부는 아래에 나열되고 설명되어 있습니다.
반응물의 농도
반응물의 농도가 높을수록 더 많은 분자가 충돌 할 수 있습니다.

온도
온도가 높을수록 반응물이 더 많은 운동 에너지를 갖습니다. 더 많은 운동 에너지를 사용하면 분자가 더 빨리 움직입니다. 따라서 반응물은 더 자주 그리고 더 많은 에너지로 충돌합니다.
압력
압력을 증가시킴으로써, 반응물 분자 사이의 공간은 감소한다. 공간이 적 으면 분자는 더 자주 충돌합니다.
물질 상태
가스는 액체보다 빠르며 고체보다 빠릅니다. 예를 들어, 사람들이 방에서 임의의 방향으로 달리는 경우 걷는 것보다 충돌 할 가능성이 높습니다.
촉매
촉매는 반응 속도를 높이고 분자가 충돌하는 메커니즘을 변화시킨다. 그것들은 반응에 의해 소비되지 않으며 변경되지 않은 상태로 유지됩니다. 촉매는 반응에 필요한 활성화 에너지를 낮추어 반응 속도를 높입니다.
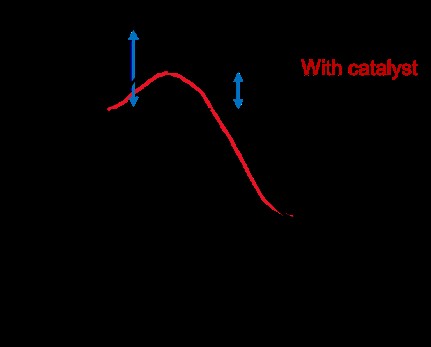
충돌 이론이 중요한 이유는 무엇입니까?
충돌 이론은 반응 속도를 높이는 방법을 설명합니다. 충돌을 증가시키는 모든 요소를 분석함으로써 수학적 방정식은 속도 방정식을 형성하는 데 사용됩니다. 반응 속도는 충돌을 증가시키는 요인에 달려 있습니다. 필요한 제품을 효과적으로 만들기위한 반응 속도를 결정하고 조작 할 수 있어야합니다.