당신은 모두 일상 생활에서 수박, 건포도 푸딩 및 매실 푸딩을 보았을 것입니다. Thomson Atomic Model이라고 불리는 원자의 초기 모델 중 하나는 외관 측면에서 이러한 식품과 비교되었습니다. 이 기사는이 Thomson Atomic 모델을 자세히 논의하는 것을 목표로합니다.
역사
아 원자 입자가 발견되기 전에 Dalton의 원자 이론은 John Dalton에 의해 주어졌습니다. 이 이론에서, 그는 원자를 불가분의 입자로 묘사했으며, 이는 더 작은 입자로 분해 될 수 없음을 의미합니다. 나중에 Dalton Atomic 이론에서 제안 된 가정은 JJ Thomson의 아 원자 입자 발견으로 인해 비 승인되었습니다.
JJ Thomson의 아 원자 입자에 대한 발견으로 인해 원자가 시작되는 방법에 대한 검색이 시작되었습니다. 원자 구조에 대한 모델을 제안한 많은 과학자 중 J.J. Thomson이 첫 번째였습니다. 1897 년, 그는 캐소드 레이 튜브 실험이라는 실험을 통해 음으로 하전 된 입자를 발견했습니다. 이 입자에“전자”라는 이름이 주어졌습니다. J.J.에 따르면 Thomson, 전자는 양성자보다 2,000 배 더 가볍습니다. 그는 또한 원자가 양전하의 구체에서 음으로 하전 된 입자의 구름을 포함한다고 믿었다. 러더 포드와 J.J. Thomson은 먼저 X- 레이에서 공기가 어떻게 이온화되는지 보여주었습니다.
Thomson의 원자 모델
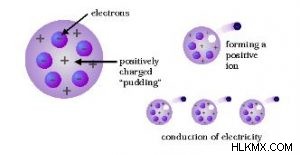
원자의 많은 과학적 모델 중에서 Thomson Atomic 모델은 우리가 외관상 수박과 비교할 수있는 모델입니다. 이것은 검은 씨앗이 수박의 붉은 식용 부분에 분산되는 것처럼 전자가 원자의 양으로 하전 된 구체에 분산되어 있음을 시사하기 때문입니다. 이 모델은 1903 년 J.J.에 의해 제공되었습니다. 톰슨은 전자를 발견 한 후. 그 당시, 원자의 핵은 발견되지 않았다. 따라서 그는 당시 알려진 원자의 특성을 기반으로 한 모델을 제안했습니다. 그게 :
- 원자는 중립 전하를 가지고 있습니다. 그것들은 그들 안에있는 두 가지 유형의 요금이 서로 균형을 이루기 때문에 긍정적이거나 부정적인 부과되지 않습니다.
- 원자는 전자로 알려진 음으로 하전 된 입자로 구성됩니다.
Thomson의 원자 모델의 가정
Thomson의 원자 모델의 이러한 가정에 따르면, 원자는 전자라고 불리는 음의 하전 입자를 포함하는 양전하의 구체처럼 보입니다. 음으로 하전 된 입자와 양전하의 크기가 동일하므로 서로 균형을 잡으므로 원자는 전기적으로 중립적이며 전하가 없습니다.
Thomson이 제안한 원자 모델은 수박이나 구형 자두 푸딩처럼 보입니다. 이 모델에서 전자는 매실 푸딩 외관과 마찬가지로 양전하의 구체에 내장 된 건포도처럼 보이기 때문입니다. 과일의 붉은 식용 부분이 양으로 하전 된 구체와 비교 될 수 있고, 과일에 분산 된 검은 씨앗은 구의 전자와 비슷하기 때문에 수박처럼 보입니다.
.

Thomson의 원자 모델 작업
J.J.에 의해 일련의 실험을 수행했습니다. 음극 광선의 특성을 관찰하는 Thomson. 목표는 음극 광선이 음으로 하전된다는 결론을 내리는 것이 었습니다. 그가 디자인 한 장치는 캐소드 광선 튜브로 알려져 있습니다. 요즘에는 '전자 총'이라고도합니다.
전자는 튜브의 왼쪽에있는 음극에서 양극을 통해 오른쪽의 인광 스크린으로 이동합니다. 그는 자기장이 꺼지면 전기장이 빔을 편향시킬 수 있음을 관찰했다. 그는 또한 우리가 자기장 및 전기장의 강도를 조정하면 캐소드 광선에서는 변형이 보이지 않았다는 것을 알아 차렸다.
압력이 낮 으면 (수은 약 1mm), 음극 광선은 어둡고 음극 근처에서 약간 발산됩니다. 이 어두운 공간의 확산은 튜브가 퍼지처럼 보일 때까지 튜브를 통해 발생합니다. 유리에 도달하거나 인광 화면에 닿으면 음극 광선이 에너지를 흡수함에 따라 빛나는 것처럼 보입니다. 그는 전하 대 질량비 계산을 위해 장치 길이, 편향 및 자기장 및 전기장의 강도를 측정했습니다. 그는이 비율이 금속과 튜브 내부의 가스에 의존하지 않는다는 것을 관찰했다. 이로 인해 음으로 하전 된 입자가 원자 입자라는 결론에 도달했습니다.
그는 우리가 하전 입자의 움직임에 수직 인 방향으로 강도 B를 갖는 균일 한 자기장을 적용 할 때 원형 경로에서 편향된다는 것을 알아 차렸다. 자기장 'QVB'를 중심 가속도의 질량 시간과 동일하게 유지 함으로써이 원형 경로의 반경 R을 얻을 수 있습니다. 후속 실험에서, Thomson은 캐소드 광고 빔이 편향되지 않는 방식으로 자기 및 전기장을 변경 하였다; 오히려, 그것은 똑바로있을 것입니다. 자기 및 전기력을 동일하게함으로써 그는 속도 v.
를 찾을 수있었습니다.자두 푸딩 모델의 응용
- J.J.의 음극선 실험 Thomson은 현대 전자 제품을 위해 길을 만들었고 다이오드와 트랜지스터의 발견의 기초를 형성했습니다. 연구원들은 캐소드 광선이 직선으로 전파 된 실험에서 결론을 내 렸으며 파도의 특성을 연구하는 데 도움이되었습니다.
- 음극선 튜브는 오늘날 전자 장치에서 널리 사용됩니다.
- J.J.가 수행 한 실험 Thomson은 현대 양자 물리학에 혁명을 일으켰습니다.
톰슨 원자 모델의 한계
- 그의 원자 모델은 양전하가 원자에서 음으로 하전 된 전자를 어떻게 유지하는지 설명 할 수 없어서 원자의 안정성을 설명하지 못하게했습니다. 결과적 으로이 가설은 원자의 핵의 위치를 설명 할 수 없었습니다.
- Thomson의 모델은 얇은 금속 포일이 알파 입자를 어떻게 산란시키는 지 설명 할 수 없었습니다.
- 그에 대한 실험적 증거는 없습니다.
Thomson의 모델은 원자 구조를 정확하게 나타내지 않았지만 다양한 원자 모델을 만드는 기초가되었습니다. 여기에서 원자 구조의 PDF를 찾으십시오. 인류의 발전에 크게 기여한 수많은 기술이 원자와 그 구조에 대한 연구에 의해 가능해졌습니다.
다른 원자 모델
Rutherford의 원자 모델
플럼 푸딩 모델이 원자 구조의 특정 측면을 설명하지 못했기 때문에 Ernest Rutherford라는 영국 과학자가 실험을 수행했습니다. 이 실험에서 그가 한 관찰에 근거하여, 그는 자신의 원자 모델을 주었다. 그에 따르면, 양전하와 원자 질량의 대부분은 핵이라고 불리는 작은 부피로 채워져 있습니다. 그는 또한 전자가 핵을 둘러싸고 원형 경로로 공전 할 것을 제안했다. 핵이 밀도로 농축 된 양의 양전하 덩어리로 간주 되었기 때문에 그 주위에 회전하는 전자는 음으로 하전되며, 정전기력이라는 강력한 인력에 의해 함께 고정됩니다.
.Bohr의 원자 모델
Neil Bohr는 1915 년 Rutherford의 원자 모델을 수정하여 원자 모델을 제공했습니다. 위에서 논의한 바와 같이, Rutherford는 원자가 양전하로 농축 된 핵을 함유하고 있으며 궤도라고 불리는 원형 경로에서 회전하는 음으로 하전 된 전자로 둘러싸여 있다고 제안했습니다. Bohr는 이러한 궤도 궤도 껍질을 불렀으며 각 궤도는 고정 된 양의 에너지를 가지고 있으며, 다른 수준은 1,2,3 등으로 표시됩니다. 숫자는 핵에서 시작되며 n =1은 가장 낮은 에너지 수준으로 간주됩니다. 후속 궤도 쉘은 K, L, M…로 지정됩니다. N =1,2,3… .. 에너지 수준이 가장 낮은지면 상태에서 전자가 고려됩니다.
원자에서, 전자는 일정량의 에너지를 얻고 낮은 에너지 수준에서 더 높은 수준의 에너지로 이동합니다. 에너지가 손실되면 전자는 더 높은 에너지 수준에서 더 낮은 수준의 에너지로 이동합니다.
결론
원자 모델의 JJ Thomson 발견은 오늘날 유효하지 않으며 한계가 있지만 나중에 밝은 다른 원자 구조 모델의 길을 열었습니다. 그것은 나중에 실질적인 혁명적 발명을 제공하는 기초 모델 역할을했습니다.
자주 묻는 질문
1. 원자 모델의 Thomson 발견이 왜 폐기 되었습니까?
A) Thomson의 원자 모델은 원자의 안정성을 설명 할 수 없었습니다. 또한 Thomson은 전자가 수박에 씨앗이 분산되는 방식과 유사한 방식으로 원자에 분포되어 푸딩에 분산된다고 제안했습니다. 그것은 긍정적으로 하전 된 구 안에 낮은 전자가 고정되어 있다고 설명 할 수 없었습니다. 따라서 폐기되었습니다.
2. 원자 모델의 Thomson 발견의 중요한 특성을 제공하십시오.
a) 원자 모델의 Thomson 발견은 다음과 같은 특성을 가졌습니다.
- 원자는 전자가 분산되는 양전하의 구체로 구성됩니다.
- 원자에서 양의 양과 음수의 양은 전기적으로 중립적이기 때문에 동일합니다.
3. Thomson의 모델은 무엇입니까?
A) Thomson이 제공 한 원자 모델은 수박과 비교하여 붉은 식용 부분이 긍정적으로 하전 된 구체처럼 보이는 반면, 검은 씨앗은 구체 내의 전자에 3333333으로 분산되어 있습니다.
4. Thomson의 원자 모델은 무엇을 설명하지 않았습니까?
A) Thomson의 원자 모델은 원자의 안정성을 설명하지 않았습니다. 또한 양성자와 중성자, 중성자 또는 핵에 대해 언급하지 않았습니다.