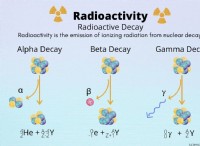
Heisenberg 불확실성 원칙
핵심 원칙은 heisenberg 불확실성 원리 입니다. . 그것은 당신이 완벽한 정확도로 입자의 위치와 운동량 (그리고 속도)을 동시에 알 수 없다고 말합니다. 하나를 더 정확하게 결정할수록 다른 것을 덜 결정할 수 있습니다.
측정 위치가 속도에 영향을 미치는 이유
1. 파동 입자 이중성 : 모든 양자 입자와 마찬가지로 전자는 파동 입자 이중성을 나타냅니다. 그것들은 정의 된 위치를 가진 입자와 정의 된 운동량 (속도와 관련된)을 가진 파로 행동합니다.
2. 상호 작용으로서 측정 : 전자 위치를 측정하려고하면 필연적으로 상호 작용합니다. 이 상호 작용은 파도와 같은 특성을 방해합니다.
3. 파동 붕괴 : 측정 행위는 전자의 파동 기능을 "붕괴"하도록 강요하며, 이는 여러 가능한 위치의 중첩에서 단일의 명확한 위치로 전환됩니다.
4. 운동량 불확실성 : 이 파동 함수의 붕괴는 전자 운동량에서 불확실성을 도입합니다. 이 불확실성은 위치 측정의 정확도에 반비례합니다. 위치 측정이 정확할수록 운동량의 불확실성이 커집니다 (따라서 속도).
비유
바다에서 특정 파도를 찾으려고한다고 상상해보십시오. 부표를 사용하여 위치를 표시 할 수 있습니다. 그러나 부표를 배치하는 행위는 파도를 방해하고 방향과 운동량을 변화시킵니다.
결론
전자 위치를 측정하는 것은 파동 입자 이원성과 피할 수없는 측정의 상호 작용으로 인한 속도에 본질적으로 영향을 미칩니다. 이것은 양자 역학의 기본 원칙이며, 아 원자 세계에 대한 우리의 이해에 큰 영향을 미칩니다.