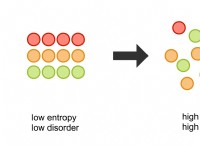
이유는 다음과 같습니다.
* 분자간 힘 : 이들은 분자를 고체로 유지하는 힘입니다. 분자간 힘이 강할수록 고체의 용융점이 높아집니다.
* Co₂ 구조 : 이산화탄소는 2 개의 극성 결합 (C =O)을 갖는 선형 분자이다. 그러나, 대칭 구조로 인해 쌍극자 모멘트가 상쇄되어 분자가 비극성을 만듭니다. 이것은 존재하는 1 차 분자간 힘이 약한 런던 분산 힘 라는 것을 의미합니다. .
* 낮은 용융점 : 드라이 아이스는 분자를 함께 유지하는 유일한 힘이 런던 분산 힘이 약하기 때문에 녹는 점 (-78.5 ° C)이 매우 낮습니다.
분자간 힘이 약한 고체의 다른 예는 다음과 같습니다.
* 고귀한 가스 : 헬륨, 네온, 아르곤 등. 매우 낮은 온도에서 고체로 존재하며 런던 분산 힘 만 있습니다.
* 비극성 분자 : 메탄 (CHAT) 및 요오드 (IA)와 같은 분자는 또한 분자간 힘이 약합니다.
참고 : 분자간 힘의 강도는 다음과 같이 증가합니다.
* 분자 크기 : 더 큰 분자는 더 많은 전자를 가지므로 런던 분산 힘이 더 강합니다.
* 극성 : 극성 분자는 쌍극자 분산 힘보다 강력한 쌍극자 쌍극자 상호 작용을 가지고 있습니다.
* 수소 결합 : 이것은 수소가 산소, 질소 또는 불소와 같은 고도로 전기 음성 원자에 결합 될 때 발생하는 특수한 유형의 쌍극자 쌍극자 상호 작용입니다. 가장 강력한 유형의 분자간 힘입니다.