관찰 :
* 화학 결합의 열쇠로 전자 : 루이스는 화학 반응 중에 원자가 전자를 얻거나 잃거나 공유하는 경향이 있음을 관찰했습니다. 그는 전자의 거동이 화학적 결합을 유도하는 주요 힘이라고 제안했다.
* 고귀한 가스의 안정성 : 그는 고귀한 가스 요소 (He, NE, AR 등)는 엄청나게 반응하지 않아 전자 배열에서 특별한 안정성을 시사한다.
루이스의 제안 :
1. 옥트 규칙 : 그의 관찰에 근거하여, 루이스는 "옥트 규칙"을 제안했는데, 이는 원자가 고귀한 가스와 유사한 가장 바깥 쪽 쉘에서 8 개의 전자의 안정적인 구성을 달성하기 위해 전자를 얻거나 잃거나 공유하는 경향이 있다고 밝혔다. 이 규칙은 화학적 결합을 이해하고 화합물의 공식을 예측하기위한 프레임 워크를 제공했습니다.
2. 전자 점 구조 (Lewis 구조) : Lewis는 기호 주위의 점을 사용하여 원자의 원자가 전자를 나타내는 간단한 방법을 도입했습니다. 이 "루이스 구조"는 전자가 분자에 분포 된 방법을 시각적으로 표현하여 결합을 이해하고 분자의 기하학을 예측하는 데 도움이되었다.
3. 전자 쌍의 개념 : 루이스는 전자가 원자 내의 쌍에 존재하고 이들 쌍은 화학적 결합에 관여한다고 제안했다. 이로 인해 두 개의 원자가 한 쌍의 전자를 공유하는 "공유 결합"의 개념이 개발되었습니다.
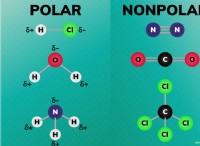
4. 극성 공유 결합 : 루이스는 공유 결합의 전자가 항상 동일하게 공유되는 것은 아니라는 것을 인식했다. 그는 어떤 경우에는 한 원자가 공유 전자 쌍을 다른 원자보다 더 강하게 끌어 올릴 수 있으며 "극성 공유 결합"을 생성 할 수 있다고 제안했다. 이 개념은 원소와 극성 분자의 특성 사이의 전기 음성 성의 차이를 설명했다.
루이스의 작업의 영향 :
루이스의 관찰과 이론은 화학적 결합에 대한 이해에 혁명을 일으켰다. 그의 기여는 다음을 포함하여 현대 화학의 발전에 기초가되었습니다.
* 원자가 결합 이론 : Lewis의 작업은 Ealence Bond 이론과 같은보다 정교한 이론의 발전을위한 토대를 마련했으며, 이는 공유 결합의 형성을보다 자세히 설명합니다.
* 분자 궤도 이론 : 분자에서 전자의 행동을 설명하는이 이론은 또한 전자 행동에 대한 Lewis의 통찰력에 뿌리를 빚지고 있습니다.
* 화학 반응 이해 : Lewis의 아이디어는 원자가 상호 작용하는 방법을 이해하기위한 프레임 워크를 제공하여 화학 반응의 메커니즘과 제품을 더 잘 파악하게되었습니다.
전반적으로 Gilbert Lewis의 화학에 대한 기여는 심오했습니다. 그의 예리한 관찰과 통찰력있는 이론은 원자 구조와 화학적 결합에 대한 현대의 이해를 확립하는 데 도움이되었으며, 그는 징계의 역사에서 중요한 인물이되었습니다.