설탕이 물에 혼합되면 설탕을 함께 잡고있는 분자간 힘은 물 분자의 힘보다 약합니다. 물 분자는 설탕을 둘러싸고 용액으로 분리합니다. 혼합물을 교반하면 더 많은 입자가 물과 접촉하여 설탕을 더 빨리 용해시키는 데 도움이됩니다.
나는 최근에 절대적인 폭발을 일으키는 12 명의 아이들로 둘러싸인 어린이의 생일 파티에서 나 자신을 발견했습니다 (그리고 명백히 호스트에게 힘든 시간을주었습니다). 내가 쿠키의 공정한 몫을 먹는 동안 나는 주스에 첨가 된 설탕에 대해 이야기하고있는 두 명의 아이들 옆에서 나 자신을 발견했습니다. 그들은 그것을 저어 준 후 마술처럼 사라지는 것처럼 보였기 때문에 그것이 어디로 갔는지 궁금했습니다.
설탕이 녹아서 사라 졌다고 말하고 싶었습니다. 분명히, 우리 모두는 설탕이 물에 섞일 때 액체를 잠시 한두 시간 동안 저어 후 빠르게 사라진다는 것을 알고 있습니다. 아이 롤과 어깨를 으 rug와 함께“용해되기 때문에”라고 말하는 것만으로도 질문은 완전히 대답 할 수 없습니다.
자, 이것의 맨 아래로 내려 갑시다. 설탕이 해산 된 후 지구상 어디로 가는가?
물질의 물리적 상태 (또는 단계)는 구성 입자를 함께 유지하는 힘, 즉 분자간 힘에 의해 결정된다. 예를 들어 고체를 가져 가십시오. 고체를 구성하는 구성 분자는 강한 구조 (격자)에서 강한 분자간 힘에 의해 함께 유지된다. 이것은 강도, 강성, 비 압축성 등을 포함하여 고체에 여러 가지 물리적 특성을 부여합니다.
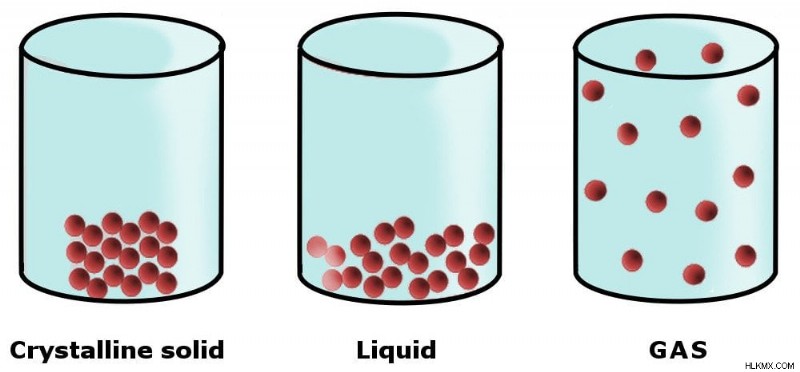
고체, 액체 및 가스에서 구성 입자의 배열
액체의 경우, 분자간 힘은 고체보다 약하기 때문에 액체는 자체 형태의 명확한 모양을 갖지 않습니다. 대신, 그들은 보관 된 용기의 모양을 취합니다.
솔리드 (따라서 격자 구조)이기 때문에 설탕 큐브의 모양과 외관은 구성 입자를 함께 유지하는 강력한 매력에 기인합니다. 그러나 큐브가 물과 접촉 할 때,이 힘은 가공되고 큐브는 모양을 잃어 빠르게 붕괴됩니다.
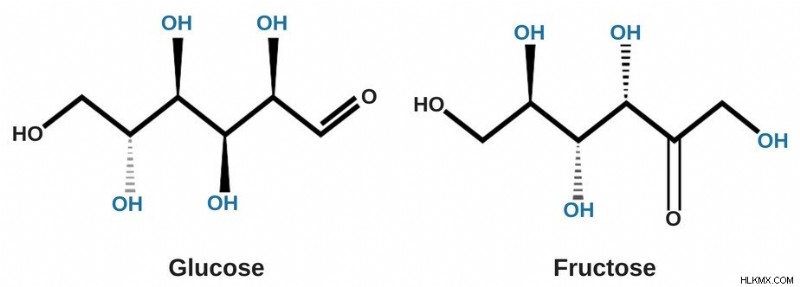
아시다시피, 당 분자는 주변의 물 분자와 쉽게 수소 결합을 만드는 하이드 록실 그룹 (OH)으로 구성됩니다. 이제 수소 결합에 대해 알아야 할 한 가지는 매우 강력하다는 것입니다.
실제로, 그것들은 자연에서 가장 강력한 분자간 관광 명소 중 하나이며, 이온 성 및 공유 결합보다 약합니다. 이 결합은 또한 큐브의 격자 모양에서 분자를 고정하는 분자간 힘보다 더 강합니다. 결과적으로, 물 분자는 작은 설탕 큐브를 둘러싸고 주변 분자의 매력적인 힘에서 벗어나 용액으로 끌어 당깁니다. 이 과정은 큐브가 확산되고 주된 구조로부터 완전히 분리 된 후 마침내 사라질 때까지 잠시 지속됩니다 (물 온도, 채도, 교반 등과 같은 몇 가지 요인에 따라)
.물에 설탕을 더 빨리 용해시키는 데 도움이되는 이유는 무엇입니까?
물로 채워진 유리에 설탕 덩어리를 단순히 떨어 뜨리면 물 분자가 표면의 입자와 접촉 할 수 있으므로 용해가 현저히 느려질 것입니다. 그러나 용액을 저어 주면 본질적으로 더 많은 입자를 물과 접촉하여 용해 과정을 훨씬 빠르게 만듭니다.
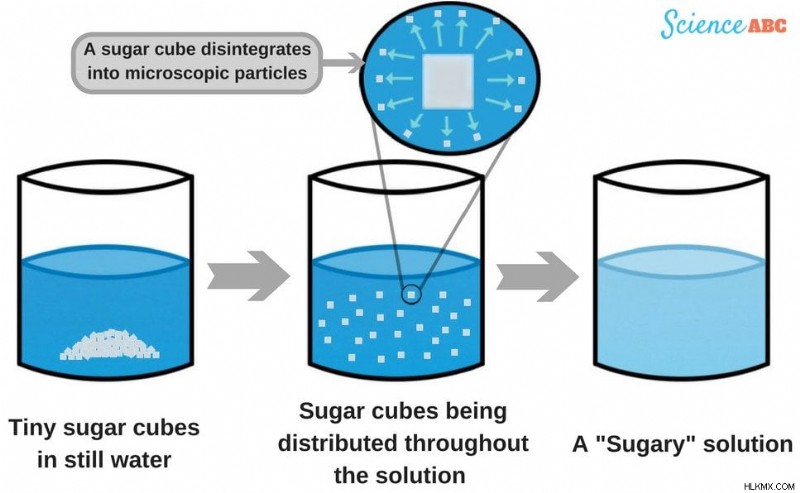
설탕 큐브는 미세한 입자로 분해되어 용액 전체에 섞어 마침내 육안으로 보이지 않게됩니다
많은 사람들이 많은 문제를 해결하는 또 다른 질문은 설탕 용해가 물리적 변화인지 화학 물질인지 여부입니다. 화학적 변화가 되려면 용해의 결과로 새로운 것을 생산해야하기 때문에 물리적 변화입니다. 그건 그렇고, 이것은 일어나지 않습니다. 물에 설탕을 녹인 후 얻은 것은 더 이상 '단 설매'솔루션입니다. 구성 요소의 정체성은 변하지 않습니다.
다음에 저어 줄 때 사라지는 설탕 큐브에 대해 궁금한 아이를 만나면이 정보는 꽤 편리 할 수 있습니다. 무엇보다도, 단순히‘설탕이 물에 녹인다’는 말로 토론을 마무리하지 말아야합니다.