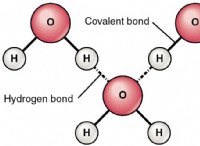
과정 이해
* 증발 : 이것은 액체 물에서 수증기 (가스)로 위상 변화입니다.
* 기화 열 : 물질 1 그램의 물질을 끓는점에서 액체에서 가스로 바꾸는 데 필요한 에너지의 양.
계산
1. 물의 기화 열 : 물의 기화 열은 끓는점 (100 ° C)에서 약 2260 j/g (그램 당 줄)입니다. 그러나 우리는 실온에서 시작한다는 사실을 설명해야합니다.
2. 물의 비열 용량 : 이것은 1 그램의 물 온도를 1도 섭씨 1 도로 높이는 데 필요한 에너지의 양입니다. 약 4.184 j/g ° C입니다.
3. 온도 차이 : 실내 온도가 25 ° C라고 가정합니다. 물 온도를 25 ° C ~ 100 ° C (75 ° C 차이)로 높여야합니다.
단계
1. 온도를 높이기위한 에너지 :
* 에너지 =(질량) * (특정 열 용량) * (온도 변화)
* 에너지 =1G * 4.184 J/G ° C * 75 ° C =313.8 J
2. 기화를위한 에너지 :
* 에너지 =(질량) * (기화 열)
* 에너지 =1G * 2260 J/G =2260 J
3. 총 에너지 :
* 총 에너지 =온도 + 에너지를 높이기위한 에너지
* 총 에너지 =313.8 J + 2260 J =2573.8 J
따라서 실온에서 1 그램의 물을 증발하려면 약 2573.8 에너지가 필요합니다.
중요한 참고 : 이것은 근사치입니다. 필요한 실제 에너지는 정확한 실온 및 대기압에 따라 약간 달라질 수 있습니다.