보는 것은 믿어 지지만 인간만큼 시각적으로 지향적 인 생물에게는 이해도 이해하고 있습니다. 지난 세기의 생물학적 진보는 과학자들이 DNA 나선, 단백질 채널 및 기타 생체 분자가 세포의 환경 내에서 어떻게 보이는지를 상상할 수 있다는 점에서 비롯되었습니다. 올해의 노벨 화학상은 냉동 전자 현미경을 개발하는 데있어 3 명의 과학자를 축하합니다. 이는 말 그대로 미드 모션에서 살아있는 세포에서 생체 분자를 동결시키고 원자 수준으로 이미지를 해결하는 기술입니다.
.Jacques Dubochet은 스위스에있는 로잔 대학교, Columbia University의 Joachim Frank 및 Cambridge의 MRC 실험실의 Richard Henderson의 Joachim Frank는 생물학적 영상 상태를 개선하기 위해 수십 년 동안 개별적으로 추구 한 노벨상을 공유 할 것입니다. Cryo-Electron 현미경은 일반적으로 Cryo-EM이라고 불리는 짧게, 그들의 기여와 동료들의 아이디어의 아이디어입니다.
단백질 및 기타 생체 분자는 본질적으로 나노 머신이며, 이들에 대한 상세한 이해는 세포막에 앉거나 용액에 떠있는 상태에서 모양이 어떻게 변화하고, 다른 분자에 결합하고, 이온을 통과하는지 정밀하게 알아야합니다. 그런 식으로 그들을 보는 데 어려움은 그들의 맛을 극복하는 것 이상입니다. 화학 고정 및 얼룩은 현미경을 위해 생체 분자를 고정시킬 수 있지만 일반적으로 과정에서 분자의 형태와 구성을 변경합니다. 기존의 동결은 도움이되지 않습니다 :얼음 결정은 세포막을 파열시키고 단백질을 주위에 밀어 넣습니다. 생체 분자는 물이 얼어 붙는 것보다 빠르게 반응합니다. 그리고 증발 얼음 결정은 이미지의 충실도를 방해합니다.
20 세기 중반, 과학자들은 표준 전자 현미경, X- 선 결정학 및 핵 자기 공명 영상을 사용하여 생체 분자를 연구하기 시작했으며, 이러한 기술은 특히 원하는 수준의 미세 구조를 드러내면서 일부 문제를 극복했습니다. 그러나 그들 모두는 분자들이 살아있는 시스템에서 어떻게 보이고 행동했는지에 대한 어느 정도의 정확한 정보에 대해 그 답을 거래했습니다.


1975 년 헨더슨과 그의 동료들은 자주색 박테리아 광합성 안료 인 바이러스 호포 신의 연구에서 전자 현미경을 새로운 높이로 밀어 넣었습니다. 전자 현미경의 진공은 일반적으로 건조시켜 세포 물질과 혼란을 끼지만 포도당 용액으로 샘플을 안정화시켰다. 생물학적 물질의 손상을 피하기 위해 평소보다 훨씬 약한 전자 빔으로 샘플을 조명했습니다. 세균성 단백질은 세포막에서 단단히 모여 있기 때문에 Henderson의 팀은 X- 선 결정 학적 기술을 사용하여 약한 전자 빔의 회절 패턴을 해석 할 수 있습니다.
결과적으로, 그들은 바이러스 호도 팝신의 구조를 0.7 나노 미터로 해결할 수 있습니다. 단백질에 가장 적합합니다. 그러나 그 성공은 바이러스 호도 팝신의 독특하게 내성적 인 특성에 기반을 두었습니다. 보다 일반화 가능한 접근법이 필요했습니다.
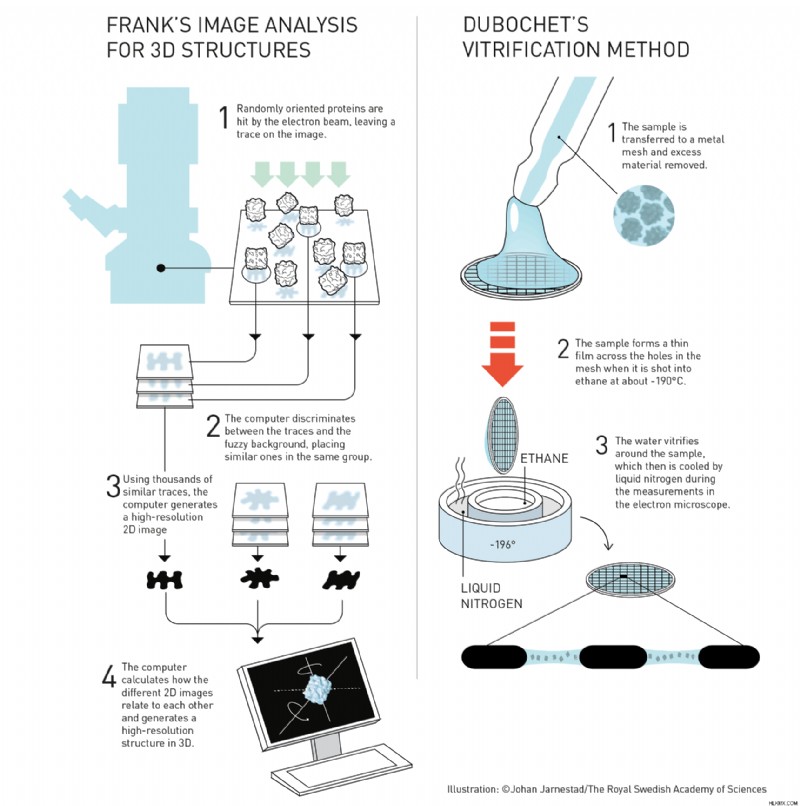
Frank는 1980 년대에 다수의 2D 전자 현미경 스캔을 고해상도 3D 이미지로 처리하는 방법을 고안함으로써 그 일부를 제공했습니다. 그가 개발 한 알고리즘을 사용하여 컴퓨터는 막에 무작위로 위치한 다수의 단백질 분자의 특징과 일치하고 평균 단백질 분자 중 하나에 대해 더 선명한 구조를 유추 할 수있다.
.한편, Dubochet은 단백질을 고정시키는 방법으로 동결을 개선하고있었습니다. 그는 생물학적 샘플이 충분히 빨리 냉동 될 수 있다면, 그 물은 결정질 얼음보다는 유리를 형성 할 것이며, 이는 덜 파괴적이다. 그는 -196도 C에서 액체 에탄 및 액체 질소를 사용한 기술을 개발하여 거의 순간적으로 전자 현미경에 대한 샘플을 동결시켰다. Dubochet의 작품은 Cryo-Em을 현실로 만들었습니다.
1991 년 Frank는 Dubochet의 냉동 유리화 기술과 자체 소프트웨어를 사용하여 4 나노 미터 해상도를 가진 리보솜의 3D 이미지를 생산했습니다. 그러나, 단백질에 대한이 놀랍지 만 여전히 불가피한 견해로는 단백질을 만족시키기에 충분하지 않았다. 이는 단백질이 개별 원자를 해결하기위한 전자 현미경을보기로 결정한 헨더슨을 만족시키기에 충분하지 않았다. 그는 미세한 이미징 기술을 개선하는 것을 계속 추진했습니다. 2013 년에 그는 단일 전자에 직접 반응하는 새롭고 민감한 탐지기로 마침내 성공했습니다.
Cryo-EM의 변형 용이성, 단순성 및 다양성으로 인해 다양한 분야의 생물학적 연구자에게는 엄청나게 유용 해졌습니다. Max Planck Institute of Biochemistry (Embl Heidelberg)의 세포 생물학 및 생물 물리학 단원 인 Martin Beck에 따르면 본질적으로 전 세계의 모든 실험실은 이제 불가능하지는 않더라도 금지하기 어려운 분자 구조 분석을 수행 할 수 있습니다. "그리고 그것은 약물 선별을 원하는 사람들에게, 질병에서 분자가 어떻게 기능하는지 이해하고자하는 사람들, HIV와 암을 이해하려는 사람들에게 엄청난 영향을 미칩니다."







