주요 차이 Sanger 시퀀싱과 차세대 시퀀싱 사이에는 Sanger 시퀀싱 과정이 한 번에 단일 DNA 단편 만 프로세스하는 반면, 차세대 시퀀싱은 한 번에 수백만 개의 단편을 동시에 처리한다는 것입니다. . 또한, Sanger 시퀀싱은 유사한 반면 차세대 시퀀싱은 디지털인데, 이는 깊은 시퀀싱을 갖는 소설 또는 드문 변이체를 검출 할 수있게한다. 또한, Sanger 시퀀싱은 적은 수의 대상, 일반적으로 최대 20 개의 목표에 대한 빠르고 비용 효율적인 방법이며, 차세대 시퀀싱은 시간이 많이 걸리고 비용 효율적인 방법입니다.
Sanger 시퀀싱 및 차세대 시퀀싱은 DNA 단편 시퀀싱의 두 가지 방법입니다. 또한, Sanger 또는 차세대 시퀀싱을 선택하는 것은 두 방법의 이점과 한계에 따라 다릅니다.
주요 영역을 다루었습니다
1. Sanger 시퀀싱이란 무엇입니까
- 정의, 프로세스, 중요성
2. 차세대 시퀀싱은 무엇입니까
- 정의, 프로세스, 중요성
3. Sanger와 차세대 시퀀싱의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. Sanger와 차세대 시퀀싱의 차이점은 무엇입니까
- 주요 차이의 비교
주요 용어
NGS (Next Generation Sequencing), 병렬 시퀀싱, SGS (Sanger Sequencing), 시퀀싱, 시퀀싱 깊이

Sanger 시퀀싱이란 무엇입니까
sanger 시퀀싱 (SGS)은 1977 년 Fredric Sanger가 개발 한 첫 번째 세대 시퀀싱 방법입니다. 이는 시험관 내에서 DNA 폴리머 라제에 의한 사슬 말단 디드 옥시 뉴클레오티드의 선택적 혼입을 포함합니다. DNA 복제. 이어서, 생성 앰플 리콘은 모세관 전기 영동에 의해 분리된다. 일반적으로 Sanger 시퀀싱은 100 개 미만의 앰플 리콘 목표를 가진 소규모 프로젝트에 대한 빠르고 비용 효율적인 시퀀싱 방법 역할을합니다. 또한, 단일 유전자의 시퀀싱에 더 좋습니다.
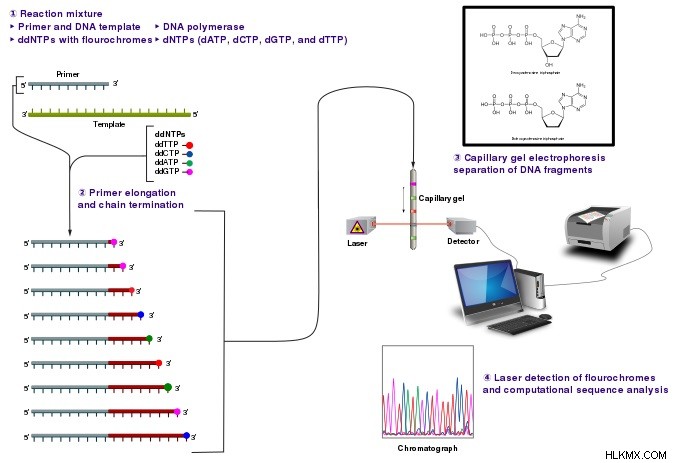
그림 1 :Sanger 시퀀싱
또한, Sanger 시퀀싱은 샘플의 모든 DNA 단편의 신호를 결합하여 단일 시퀀스를 생성하는 유사한 방법입니다. 개별 신호의 분리를 허용하지 않습니다. 따라서, 결과 신호는 혼합 신호이며, 이는 샘플에서 25% 이하의 주파수 이하로 발생하는 변이체의 식별을 허용하지 않는다.
차세대 시퀀싱이란?
차세대 시퀀싱 (NGS)은 2 세대 시퀀싱 방법입니다. 더욱이, 그것은 대규모 병렬 처리의 개념을 갖는 고 처리량 DNA 시퀀싱 접근법이다. 게놈 분석기/HESEQ/MISEQ (Illumina Solexa), 고체 시스템 (Thermo Fisher Scientific), 이온 PGM/이온 양성자 (Thermo Fisher Scientific) 및 Heliscope 시퀀서 (Helicos Biosciences)는 현재 차세대 시퀀싱을 수행하는 여러 플랫폼입니다. 일반적으로, 그들은 계측기 실행 당 백만에서 430 억 개의 짧은 판독 (각 50-400베이스)을 시퀀싱 할 수 있습니다.
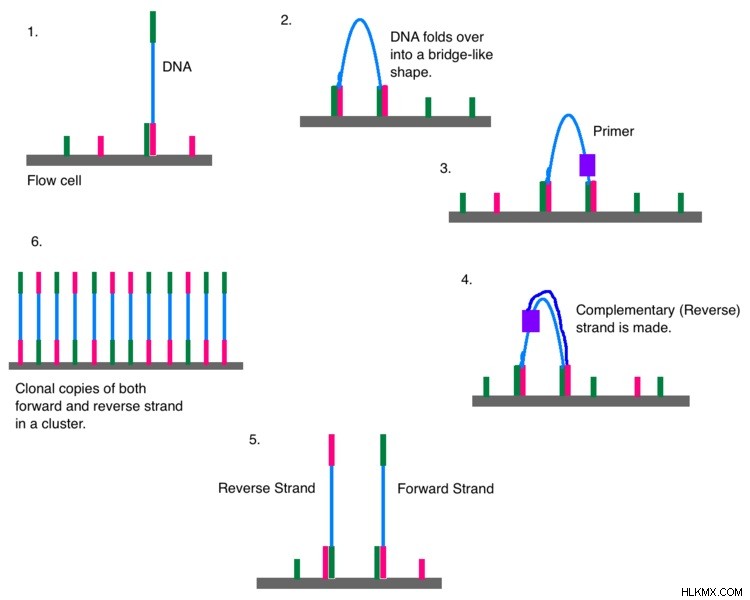
그림 2 :일루미나 시퀀싱의 클론 증폭
또한 차세대 시퀀싱의 주요 특징은 여러 대상에 대한 병렬 조사를 수행 할 수 있다는 것입니다. 돌연변이 검출의 속도와 효율성이 증가했습니다. 일반적으로 체세포 암 돌연변이에서 종양은 이질적이며 정상 세포뿐만 아니라 암 세포 모두를 포함합니다. 그러나, 병렬 시퀀싱을위한 차세대 시퀀싱에서 클론 증폭에 의한 DNA 라이브러리의 제조는 라이브러리의 각 표적 DNA 분자에서 유래하는 신호를 물리적으로 분리하는 데 도움이된다. 따라서, 이것은 정상 세포의 DNA 서열로부터 암 세포의 DNA 서열의 분리를 허용한다. 전반적으로, 차세대 시퀀싱은 깊이의 커버리지 변형이 더 높은 디지털 시퀀싱 방법입니다.
Sanger와 차세대 시퀀싱의 유사성
- Sanger 및 차세대 시퀀싱은 DNA 단편의 뉴클레오티드 서열을 결정하는 데 사용되는 두 가지 주요 방법입니다.
- 그들의 기술은 비슷하며 DNA 폴리머 라제에 의한 성장하는 주형에 형광성 뉴클레오티드를 추가하는 것을 포함합니다.
- 또한 첨가 된 뉴클레오티드의 식별은 형광 태그에 의한 것입니다.
- 또한 자동화 된 기술입니다.
Sanger와 차세대 시퀀싱의 차이
정의
Sanger 시퀀싱은 개인의 게놈의 뉴클레오티드 서열의 일부를 결정하는 데 사용되는 저급한 처리량 방법을 지칭하는 반면, 차세대 시퀀싱은 개별 게놈의 뉴클레오티드 시퀀스의 일부를 결정하는 데 사용되는 고 처리량 방법을 지칭합니다. 따라서 이것은 Sanger와 차세대 시퀀싱의 주요 차이점입니다.
다른 이름
Sanger 시퀀싱의 다른 이름은 dideoxy chain 종료 방법 또는 모세관 전기 영동 시퀀싱이며, 차세대 시퀀싱의 다른 이름은 대규모 평행 시퀀싱 또는 대규모 평행 시퀀싱입니다.
생성
Sanger 시퀀싱은 1 세대 시퀀싱 방법이며, 차세대 시퀀싱은 2 세대 시퀀싱 방법입니다.
상용화
Sanger 시퀀싱은 Applied Biosystems에 의해 먼저 상용화되었으며, 지배적 인 차세대 시퀀싱 플랫폼은 Illumina입니다.
DNA 단편의 크기
Sanger와 차세대 시퀀싱의 또 다른 차이점은 Sanger 시퀀싱이 750-1,000 기본 쌍 조각에 대해 더 잘 작동하지만 차세대 시퀀싱은 약 2 천만 기본 쌍의 긴 조각에서 더 잘 작동한다는 것입니다.
한 번에 샘플 수
또한, Sanger 시퀀싱은 한 번에 단일 DNA 단편 만 처리 할 수 있으며 차세대 시퀀싱은 한 번에 수백만 개의 단편을 동시에 처리 할 수 있습니다.
커버리지 깊이
중요하게도, Sanger 시퀀싱은 혼합물의 모든 DNA 단편을 결합하여 단일 시퀀스를 생성하는 반면, 차세대 시퀀싱은 혼합물의 단일 분자로부터 오는 각 개별 데이터를 분리 할 수 있으므로 디지털이기 때문에 유사합니다.
감도
또한 감도는 Sanger와 차세대 시퀀싱의 또 다른 차이점입니다. Sanger 시퀀싱은 약 15-20%의 검출 한계를 갖는 덜 민감한 방법이며, 차세대 시퀀싱은 검출 한계가 1% 미만인 매우 민감한 방법입니다.
저렴한 샘플 당 비용
Sanger 시퀀싱은 최대 20 개의 샘플을 빠르게 비용 효율적이며 차세대 시퀀싱은 시간이 많이 걸리고 최대 20 개의 샘플까지 비용 효율적입니다.
더 많은 수의 샘플 당 비용
Sanger 시퀀싱은 더 많은 수의 샘플에 대해 비용 효율적이지 않으며 차세대 시퀀싱은 더 많은 수의 샘플에 대해 비용 효율적입니다.
임상 연구 시퀀싱
Sanger와 차세대 시퀀싱의 또 다른 차이점은 Sanger 시퀀싱이 임상 연구 시퀀싱을위한 '골드 표준'이며 차세대 시퀀싱은 임상 실험실에서 일반적이되고 있다는 것입니다.
응용
또한, Sanger 시퀀싱은 단편 분석, 미생물 식별, STR 분석, NGS 확인 등에 중요하지만, 차세대 시퀀싱은 병원성 미생물 게놈, 전사 분석, 돌연변이 탐지 등을 포함한 게놈 시퀀싱에 중요합니다.
.결론
Sanger 시퀀싱은 1 세대 시퀀싱 방법으로, 형광-표지 된 디드 옥시 뉴클레오티드를 갖는 표적 DNA 단편의 증폭 및 모세관 전기 영동을 통한 분석을 포함한다. 일반적 으로이 방법은 적은 수의 샘플에 대해 빠르고 비용 효율적입니다. 그것은 비유 적 방법이므로 감도가 적습니다. 반면, 차세대 시퀀싱은 Sanger 시퀀싱과 유사한 기술을 갖춘 2 세대 시퀀싱 방법입니다. 수백만 개의 샘플을 한 번에 처리하는 대규모 병렬 시퀀싱 방법입니다. 또한, 차세대 시퀀싱의 주요 특징은 서열화 깊이이며, 이는 변이체를 감지 할 수있게한다. 따라서 Sanger와 차세대 시퀀싱의 주요 차이점은 샘플 처리 수와 시퀀싱의 깊이입니다.