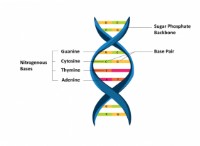
1. 소수성 상호 작용 :이들은 비극성 (소수성) 분자의 경향 또는 분자 영역의 경향으로부터 발생하는 비공유 상호 작용이다. 단백질의 비 시퀴 쿠스 내부에서, 아미노산의 소수성 측쇄가 함께 모여 물 분자를 제외한 안정적인 코어를 형성한다.
2. van der waals forces :이들은 쌍극자 쌍극자 상호 작용, 유도 쌍극자 쌍극자 상호 작용 및 런던 분산 힘을 포함하는 약한 비공유 상호 작용이다. 반 데르 발스 힘은 소수성 코어에 대한 추가 안정화를 제공함으로써 단백질 내부의 전반적인 안정성과 소형에 기여한다.
3. 수소 결합 :수소 결합은 단백질의 수성 표면에서도 널리 퍼지지 만, 비 식당 내에서도 형성 될 수있다. 이러한 수소 결합은 물 분자에 직접 노출되지 않은 아미노산의 극성 또는 전하 측쇄 사이에서 발생합니다.
4. 이황화 결합 :이황화 결합은 시스테인 잔기의 황 원자 사이에 형성된 공유 결합이다. 이러한 결합은 시토 졸의 환원 환경이 산화 세포 외 환경으로부터 차폐되는 단백질의 내부에서 더 흔합니다. 이황화 결합은 단백질의 구조적 안정성 및 강성에 기여한다.
한편, 단백질의 수성 표면은 상이한 유형의 결합으로 특징 지어진다.
1. 물과의 수소 결합 :단백질의 표면에있는 아미노산의 극성 및 하전 된 측쇄는 물 분자와 수소 결합을 형성하여 수성 환경에서 단백질의 수화 및 용해도에 기여합니다.
2. 이온 결합 :이들은 단백질 표면의 양성 및 음으로 전하 된 그룹과 주변 수용액에서 반대로 하전 된 이온 사이의 정전기 상호 작용이다. 이온 결합은 단백질의 전반적인 전하 및 다른 분자와의 상호 작용을 유지하는 데 중요한 역할을합니다.
3. 극성 상호 작용 :쌍극자-쌍극자 상호 작용 및 쌍극자-유도 쌍극자 상호 작용과 같은 극성 상호 작용은 아미노산의 극성 측쇄와 물 분자 또는 수성 환경에서 다른 극성 분자 사이에서 발생합니다.