분자 질량 하나의 분자의 질량입니다. 일반적으로 Daltons (DA) 또는 원자 질량 단위 (AMU 또는 U) 단위로 분자 질량 (M)을보고합니다. 분자 질량, 예제 계산 및 분자 질량과 몰 질량의 차이점을 찾는 방법은 다음과 같습니다.
- 분자 또는 화합물의 분자 공식을 작성하십시오.
- 공식에서 각 요소의 원자 질량을 찾으십시오.
- 각 원자 질량에 공식의 첨자로 곱합니다.
- 각 요소의 원자 질량을 추가하십시오.
분자 질량을 찾는 방법
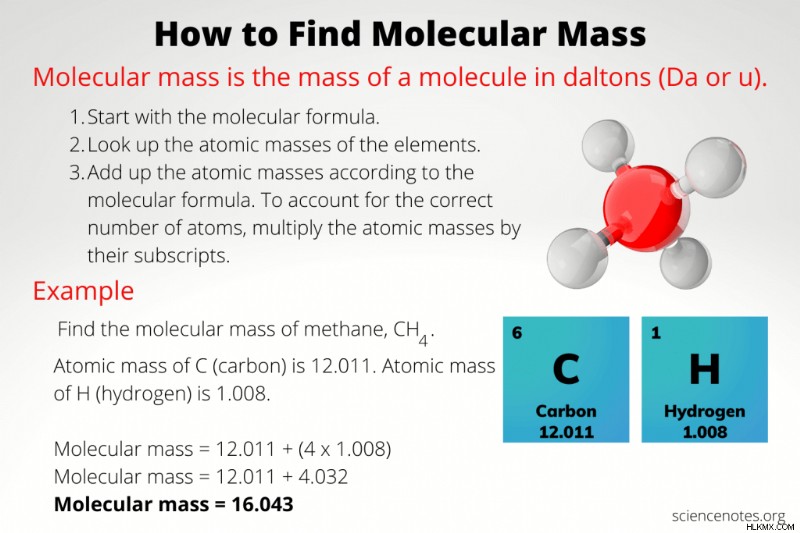
분자 질량을 계산하려면 분자를 구성하는 원자의 수와 유형을 알아야합니다. 분자의 원자 메이크업을 알면 주기성 테이블을 사용하여 각 원자의 질량을 찾고 함께 추가하십시오. 각 요소의 원자 수는 분자식의 첨자입니다. 요소 기호에 따라 첨자가 없다면, 공식에 해당 요소의 원자가 하나 있음을 의미합니다.
예를 들어, 물은 분자식 H 2 를 갖는다 O. 이것은 하나의 물 분자가 2 개의 수소 원자와 하나의 산소 원자를 함유 함을 의미합니다.
주기율표는 수소의 원자 질량이 1.0008 amu이고 산소의 원자 질량은 15.999 amu임을 보여줍니다. 물의 분자 질량은 수소 2 덩어리와 산소 덩어리가 될 것입니다.
H 2의 분자 질량 O =(2 x 1.008 amu) + (15.999 AMU)
H 2의 분자 질량 O =2.016 AMU + 15.999 AMU
H 2의 분자 질량 o =18.015 amu
물의 분자 질량은 18.015 amu입니다.
하나의 AMU는 1 그램/몰에 해당합니다. 이것이 분자의 분자량을 찾을 수있는 방법입니다. 이것은 1 몰의 물 무게가 18.015 그램입니다.
분자 질량 예제 계산
예 :
황산의 분자 질량은 무엇입니까 (h <서브> 2 그래서
솔루션 :
각각의 황산 분자는 2 개의 수소 원자, 1 개의 황 원자 및 4 개의 산소 원자를 함유한다. 따라서 분자 질량은 다음과 같습니다.
H 2의 분자 질량 그래서
주기율표에서 우리는
를 볼 수 있습니다
h =1.008 amu의 질량
S =32.066 AMU의 질량
O =15.999 AMU의 질량
이 값을 공식에 연결하십시오.
H 2의 분자 질량 그래서
H 2의 분자 질량 그래서
H 2의 분자 질량 그래서
답변 :
황산의 분자 질량은 98.078 AMU 또는 98.078 그램/몰과 같습니다.
분자 질량과 몰 질량의 차이
화합물의 몰 질량은 샘플 질량을 두더지의 수로 나눈다. 따라서 달톤 또는 AMU에서 분자 질량을보고하는 동안 몰 질량은 두더지 당 킬로그램 (kg/mol) 또는 두더지 당 그램 (g/mol)입니다. 기술적으로, 일반적인 분자 질량 계산은 실제로 어금니 질량 계산입니다. 이는 계산이 주기성 테이블의 평균 원자 질량을 사용하기 때문에 자연 요소의 동위 원소 풍부에 기초하여 가중 질량 평균입니다.
대부분의 경우 분자 질량 및 몰 질량은 상호 교환 가능합니다. 그러나 두 가지 예외가 있습니다.
- 주기율표에서 상대 원자 질량 값을 사용하지 않을 수 있습니다. 예를 들어, d 2 의 분자 질량을 고려하십시오 O, 여기서 D는 수소 동위 원소 중수소를 나타낸다. 여기서 동위 원소의 원자 질량은 2.014입니다 (일반적으로 "수소"에 사용하는 것처럼 1.008이 아님). 분자 질량은 (2 x 2.014) + 15.999 =20.027 amu입니다. 동위 원소 비율이 알려진 샘플을 사용할 때마다 동일한 상황이 적용됩니다.
- 단일 분자의 질량을 정말로 원한다면 값을 "분자 질량"이라고 부를 수 있습니다. 여기서 어금니 질량을 가져 와서 Avogadro의 번호로 나눕니다. 예를 들어, 단일 물 분자의 질량은 18.015 g/mol ÷ 6.022 x 10 분자/mol입니다. 따라서 하나의 개별 물 분자의 질량은 약 2.991 × 10 g입니다.
참조
- 국제 무게 및 측정 국 (2006). 국제 단위 (SI) (8th ed.). ISBN 92-822-2213-6.
- 순수 및 응용 화학의 국제 연합 (1993). 물리 화학의 수량, 단위 및 기호 (제 2 판). 옥스포드 :블랙웰 과학. ISBN 0-632-03583-8.
- POSSOLO, Antonio; Van der Veen, Adriaan M.H.; Meija, Juris; Hibbert, D. Brynn (2018). "표준 원자 가중치의 불확실성 해석 및 전파 (IUPAC 기술 보고서). 순수하고 응용 화학 . 90 (2) :395–424. doi :10.1515/Pac-2016-0402
- Wieser, M. E. (2006). "요소 2005의 원자량." 순수하고 응용 화학 . 78 (11) :2051–66. doi :10.1351/pac200678112051