Avogadro의 법칙은 이상적인 가스 법칙의 특정 버전입니다. 이상적인 가스의 동일한 온도에서 동일한 부피는 모두 같은 수의 분자를 가지고 있다고 말합니다. 이 Avogadro의 법률 예제 문제는 Avogadro의 법칙을 사용하여 주어진 부피의 두더지 수 또는 주어진 두더지의 부피를 찾는 방법을 보여줍니다.
avogadro의 법칙 예
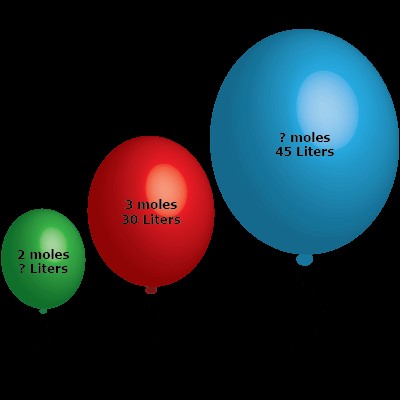
질문 : 3 개의 풍선은 다른 양의 이상적인 가스로 채워져 있습니다. 1 개의 풍선은 3 몰의 이상적인 가스로 채워져 풍선을 30 L로 채 웁니다.
a) 하나의 풍선에는 2 몰의 가스가 들어 있습니다. 풍선의 양은 얼마입니까?
b) 1 개의 풍선은 45 L의 부피를 둘러싸고 있습니다. 풍선에 몇 몰의 가스가 있습니까?
솔루션 :
Avogadro의 법칙은 부피 (v)가 같은 온도에서 가스 분자 (n)의 수에 직접 비례한다고 말합니다.
.n> v
이것은 n과 v의 비율이 일정한 값과 같다는 것을 의미합니다.

이 상수는 절대 변하지 않기 때문에 다른 양의 가스와 부피에 대해 비율은 항상 사실입니다.

어디
n i =초기 분자 수
v i =초기 볼륨
n f =최종 분자 수
v f =최종 볼륨.
파트 a) 하나의 풍선은 30 L에서 3 몰의 가스가 있습니다. 다른 풍선은 알려지지 않은 부피에 2 개의 두더지가 있습니다. 이 값을 위의 비율로 연결하십시오.
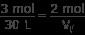
v f 에 대한 해결
(3 mol) v f =(30 L) (2 mol)
(3 mol) v f =60 l⋅mol
v f =20 l
가스가 적을 것으로 예상됩니다. 이 경우, 2 몰의 가스만이 20 l을 차지했습니다.
파트 B) 이번에는 다른 풍선의 알려진 부피가 45 L이고 알 수없는 수의 몰이 있습니다. 이전과 동일한 비율로 시작하십시오.

Part A에서 동일한 알려진 값을 사용하지만 vf에 45 L을 사용하십시오.
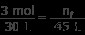
n f 를 해결하십시오
(3 mol) (45 L) =(30L) n f
135 mol⋅l =(30L) n f
n f =4.5 몰
큰 부피는 풍선에 더 많은 가스가 있음을 의미합니다. 이 경우 더 큰 풍선에는 4.5 몰의 이상적인 가스가 있습니다.
대체 방법은 알려진 값의 비율을 사용하는 것입니다. 파트 A에서, 알려진 값은 두더지의 수였다. 두 번째 풍선은 ⁄ <서브> 3 가 있었다 두더지의 수는 ⁄ 3 를 가져야합니다 볼륨과 우리의 최종 답변은 ⁄ 3 입니다 알려진 볼륨. 파트 b도 마찬가지입니다. 최종 부피는 1.5 배 더 크므로 분자의 1.5 배를 가져야합니다. 1.5 x 3 =4.5는 우리의 대답과 일치합니다. 이것은 당신의 작업을 확인하는 좋은 방법입니다.