원자의 크기는 원자가 매우 작고 전자 쉘이 구형 쉘보다 구름에 가깝기 때문에 측정하기 쉬운 속성이 아닙니다. 원자 반경과 이온 반경은 가장 일반적인 원자 크기 측정 중 하나입니다. 원자력과 이온 반경의 정의, 그들 사이의 차이 및주기적인 테이블 트렌드의 정의는 다음과 같습니다.
원자 반경
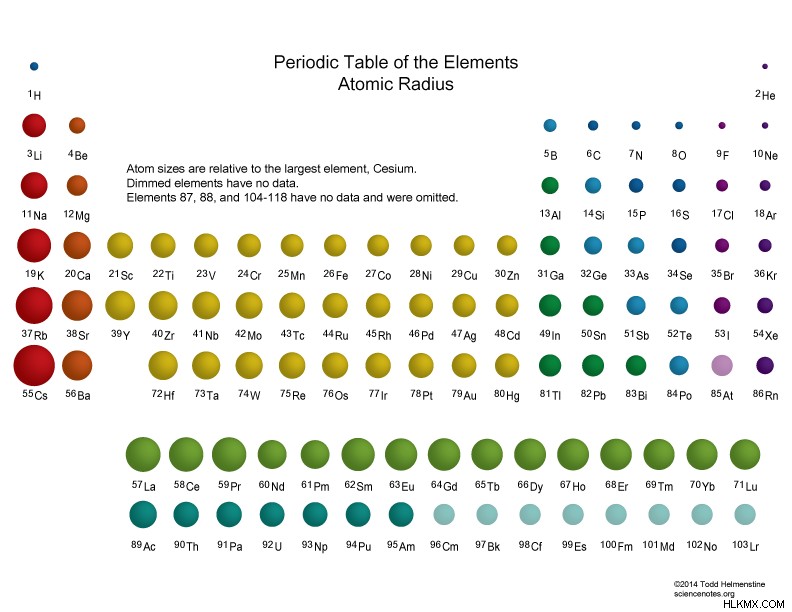
원자 반경 중성 원자의 핵 중심에서 전자 쉘의 외부 경계까지의 평균 거리입니다. 분리 된 중성 원자의 경우, 원자 핵은 30 피코 미터 (1 조 미터)와 300 pm입니다. 가장 큰 원자는 세슘이고 가장 작은 원자는 헬륨입니다. 원자 크기의 대부분은 전자에서 나옵니다. 원자 반경은 원자 핵 (1 ~ 10 펨토 미터)의 반경보다 10,000 배 이상 더 큽니다. 다시 말하면, 원자 반경은 가시 광의 파장의 1 분의 1 미만 (400 ~ 700 nm).
전자 쉘의 가장자리는 잘 정의되지 않으므로 기준에 따라 각 원자마다 다른 값을 찾을 수 있습니다. 그러나 실제 숫자는 원자의 상대 크기만큼 중요하지 않습니다.
이온 반경
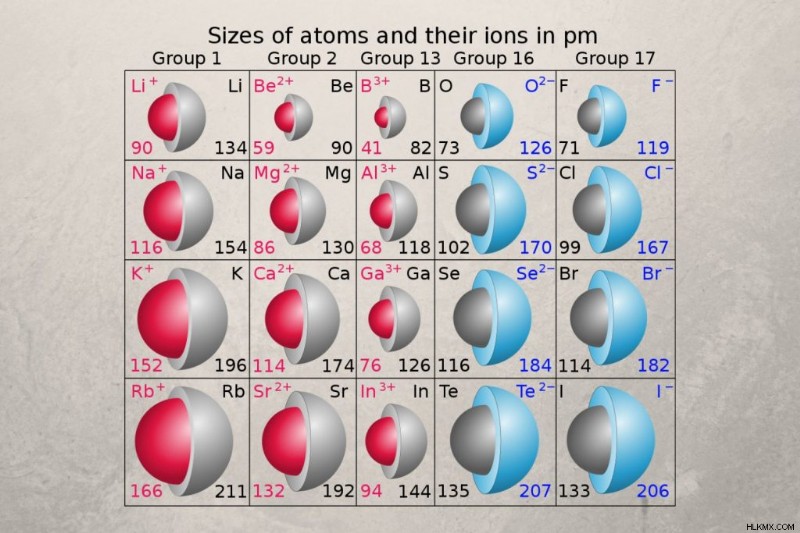
원자 반경은 중성 원자의 크기를 측정하는 반면 이온 반경 전기적으로 하전 된 원자의 크기를 측정합니다. 이온 반경은 이온 결정 내에서 원소의 모나토미 이온의 반경 또는 2 개의 결합 가스 원자 사이의 거리의 절반입니다. 이온 반경 값은 오후 31시에서 200시 이상입니다.
이온 반경은 고정 된 속성이 아니므로 요소의 이온 값은 조건에 따라 다릅니다. 조정 수와 스핀 상태는 이온 반경 측정에 영향을 미치는 주요 요인입니다. X- 선 결정학은 경험적 이온 반경 측정을 생성합니다. Pauling은 효과적인 핵 전하를 사용하여 이온 반경을 계산했습니다. 이온 반경의 표는 일반적으로 값을 결정하는 데 사용되는 방법을 나타냅니다.
주기적 테이블 트렌드
Electron Configuration은 주기성 테이블의 요소 구성을 결정하므로 원자 및 이온 반경은 주기성을 표시합니다 :
- 원자력 및 이온 반경은 주기성 테이블의 그룹 또는 열로 이동하는 증가가 증가합니다. 원자가 전자 쉘을 얻기 때문입니다.
- 원자 및 이온 반경은 일반적으로 주기성 테이블의주기 또는 행을 가로 질러 이동하는 것을 감소시킵니다. 이것은 점점 더 많은 양성자가 전자에 더 강한 인력을 가하여 더 단단히 끌어 당기기 때문입니다. 고귀한 가스는이 추세의 예외입니다. 크기 고귀한 가스 원자가 이전의 할로겐 원자보다 큽니다.
원자 반경 대 이온 반경
원자 반경과 이온 반경은 주기율표에서 동일한 경향을 따릅니다. 그러나, 이온 반경은 전하에 따라 요소의 원자 반경보다 크거나 작을 수있다. 이온 반경은 음전하에 따라 증가하고 양전하로 감소합니다.
- 양이온 또는 양성 이온 :원자는 양이온을 형성 할 때 하나 이상의 전자를 잃어 이온을 중성 원자보다 작게 만듭니다. 금속은 일반적으로 양이온을 형성하므로 이온 반경은 원자 반경보다 작습니다.
- 음이온 또는 음성 이온 :원자는 하나 이상의 전자를 얻기 위해 음이온을 형성하여 이온을 중성 원자보다 더 크게 만듭니다. 비금속은 종종 음이온을 형성하므로 이온 반경은 원자 반경보다 큰 경향이 있습니다. 이것은 특히 할로겐에게 눈에 띄는다.
원자 및 이온 반경 숙제 질문
학생들은 종종 원자와 이온 반경의 차이와주기적인 테이블 트렌드의 차이에 따라 원자와 이온의 크기를 주문해야합니다.
.예를 들어 :크기 증가 순서대로 종을 나열하십시오 :RB, RB, F, F, TE
원자와 이온의 크기를 주문하기 위해 알 필요는 없습니다. Rubidium 양이온이 Rubidium 원자보다 작다는 것을 알고 있습니다. 이온을 형성하기 위해 전자를 잃어야했기 때문입니다. 동시에, 당신은 루비듐이 전자를 잃어 버렸을 때 전자 쉘을 잃어 버렸다는 것을 알고 있습니다. 불소 음이온이 이온을 형성하기 위해 전자를 얻었 기 때문에 불소 원자보다 크다는 것을 알고 있습니다.
다음으로 주기율표를보고 요소의 원자의 상대 크기를 결정하십시오. 중성 텔루 리움은 기간에 걸쳐 움직일 때 원자 반경이 감소하기 때문에 중성 Rubidium 원자보다 작습니다. 그러나 Tellurium 원자는 추가 전자 쉘이 있기 때문에 Rubidium 양이온보다 큽니다.
모든 것을 정리하십시오 :
f
원자 및 이온 반경이 원자와 이온의 크기를 측정하는 유일한 방법은 아닙니다. 공유 반경, 반 데르 발스 반경, 금속 반경 및 보어 반경은 일부 상황에서 더 적합합니다. 이것은 원자의 크기가 화학적 결합 거동의 영향을 받기 때문입니다.
이소 전자 이온은 전자 구조와 동일한 수의 원자가 전자를 갖는 다른 원소의 양이온 또는 음이온이다. 예를 들어, K와 CA는 모두 [NE] 4S 전자 구성을 갖습니다. S 및 P는 모두 전자 구성으로서 1S 2S 2P 3S 3P를 갖는다. 등성 전자 성은 다른 원소의 이온 반경을 비교하고 전자 거동에 따라 특성을 예측하는 데 사용될 수 있습니다. 기타 원자 반경 측정
이소 전자 이온
참조