화학 반응은 한 세트의 물질 (반응물)을 다른 물질 세트 (제품)로 변형시키는 공정 또는 화학적 변화입니다. 이 과정은 원자 사이의 화학적 결합과 새로운 결합을 형성하는 것이 포함되므로 원자의 수와 유형은 반응물과 생성물 모두에 대해 동일합니다. 화학적 변화는 화학 방정식으로 설명됩니다. 화학적 반응의 여러 유형이 있습니다. 다음은 4 가지 주요 유형의 화학 반응과 추가 주요 반응 유형을 살펴 봅니다.
4 주요 화학 반응 유형
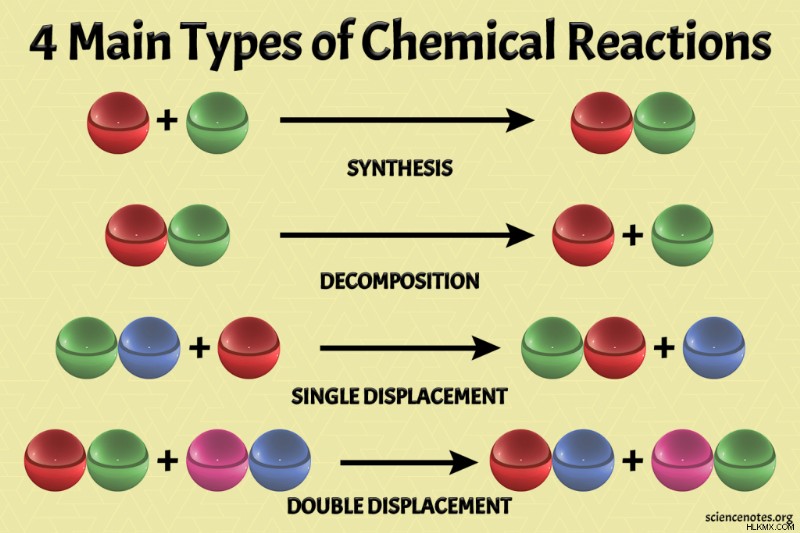
반응 유형에는 다른 이름이 있습니다. 화학 반응의 네 가지 주요 유형은 다음과 같습니다.
- 합성 또는 조합 반응
- 분해 또는 분석 반응
- 단일 교체, 단일 변위 또는 대체 반응
- 이중 교체, 이중 변위 또는 변환 반응
그러나 다른 많은 유형의 반응이 있습니다. 이 표는 주요 화학 반응의 주요 유형의 몇 가지 핵심 사항을 요약합니다.
| 반응 유형 | 일반 반응 | 설명 |
| 합성 또는 조합 | a + b → ab | 두 개 이상의 원소 또는 화합물이 결합하여 하나의 화합물을 형성합니다. |
| 분해 또는 분석 | ab → a + b | 복잡한 분자는 더 간단한 분자로 분해됩니다. |
| 변위, 교체 또는 대체 | a + bc → ac + b | 한 요소는 화합물에서 다른 요소를 대체합니다. |
| 이중 변위, 이중 교체 또는 변환 | AB + CD → AD + CB | 양이온 및 음이온 교환 파트너. |
| 연소 | a + o 2 → h 2 O + Co 2 | 화합물은 산소와 결합되어 산화물을 형성합니다. 종종 이산화탄소 및 수성 형태. |
| 산-염기 또는 중화 | 산 +베이스 → Salt + Water | 산과 염기는 소금과 물을 형성하기 위해 반응합니다. |
| 강수량 | A + 가용성 염 B → 침전물 + 가용성 염 C | 가용성 염의 두 가지 용액은 불용성 염 (침전물)을 형성하기 위해 반응합니다. |
반응의 유형을 자세히 살펴보고 예를 들어 보겠습니다 :
합성 또는 직접 조합 반응
합성, 직접 조합 또는 조성 반응에서, 2 개 (또는 그 이상의) 반응물이 결합되어보다 복잡한 생성물을 형성한다. 반응의 일반적인 형태는 다음과 같습니다.
A + B → AB
합성 반응의 예는 철과 황의 조합으로 철 (II) 황화물을 형성하는 것입니다.
8 Fe + s 8 → 8 fes
합성 반응의 다른 예는 다음과 같습니다.
- 2 na (s) + cl 2 (g) → 2 NaCl (s)
- c (s) + o 2 (g) → Co 2 (g)
- s (s) + o 2 (g) → so 2 (g)
- 2 fe (s) + o 2 (g) → 2 Feo (s)
- 2 So 2 + o 2 → 2 so 3
- 6 C + 3 H 2 → C 6 H 6
- 4 Na + 2 C + 3 O 2 → 2 na 2 Co 3
분해 또는 분석 반응
화합물은 화학적 분해 또는 분석 반응에서 작은 조각으로 파괴되거나 분해됩니다. 반응의 일반적인 형태는 다음과 같습니다.
AB → A + B
분해 반응의 예는 산소와 수소를 형성하기위한 물의 전기 분해입니다.
2 h 2 O → 2 H 2 + o 2
분해 반응의 추가 예는 다음과 같습니다.
- caco 3 → Cao + Co 2
- 2 kclo 3 → 2 kcl + 3 o 2
- na 2 Co 3 → na 2 O + Co 2
단일 대체, 단일 변위 또는 대체 반응
단일 대체, 단일 변위 또는 치환 반응은 하나의 원소가 반응물로부터 변위되어 다른 요소와 화합물을 형성 할 때입니다. 반응에는 일반적인 형태가 있습니다.
A + BC → AC + b
단일 대체 반응의 예는 아연이 염산 아연 및 수소를 형성하는 경우 아연이 염산과 수소를 형성하는 경우입니다. 아연은 염산에서 수소를 대체하거나 대체합니다.
Zn + 2 HCl → Zncl 2 + h 2
이중 교체, 이중 변위 또는 전지 반응
반응물 양이온 및 음이온이 "스왑 파트너"를 할 때 반응을 이중 대체, 이중 변위 또는 변환 반응이라고합니다. 이중 교체 반응의 일반적인 형태는 다음과 같습니다.
AB + CD → AD + CB
이중 대체 반응의 예는 염화나트륨과 질산 나트산 나트륨 사이의 반응과 질산 나트륨과 염화은을 생성하는 것입니다.
NaCl (aq) + agno 3 (aq) → Nano 3 (aq) + agcl (s)
연소 반응
연소 반응은 연료와 산소 사이의 반응으로 하나 이상의 산화물을 형성하는 것입니다. 많은 연료가 탄소 기반이기 때문에 이산화탄소 (Co 2 )는 종종 제품입니다. 때때로 물 (h 2 o)는 제품입니다.
다음은 연소 반응과 균형 잡힌 방정식의 예입니다.
- c 10 H 8 + 12 o 2 → 10 Co 2 + 4 h 2 o
- h 2 + o 2 → 2 h 2 o
- c 6 H 12 o 6 + 6 o 2 → 6 Co 2 + 6 h 2 o
- 2 fe 2 s 3 + 9 o 2 → 2 fe 2 o 3 + 6 so 2
- 2 al 2 s 3 + 9 o 2 → 2 al 2 o 3 + 6 so 2
- p 4 + 5 o 2 → 2 p 2 o 5
산-염기 또는 중화 반응
산-염기 반응은 산과 염기 사이에서 발생하는 이중 대체 반응의 한 유형이다. 산의 H 이온은 바닥의 OH 이온과 반응하여 물과 이온 성 염을 형성합니다.
HA + BOH → H 2 O + BA
수소산 (HBR)과 수산화 나트륨 사이의 반응은 산-염기 반응의 예입니다.
hbr + naoh → nabr + h 2 o
산화 감소 또는 산화 환원 반응
산화 환원은 감소 및 산화의 약자입니다. 두 프로세스가 함께 발생합니다. 이러한 유형의 반응은 반응물 사이의 전자 전달과 산화 수의 변화를 포함한다. 예는 i 2 의 감소입니다 i를 형성하고 s 2 의 산화 o 3 (티오 설페이트 음이온) s 4 를 형성합니다 o 6 :
2 s 2 o 3 (aq) + i 2 (aq) → s 4 o 6 (aq) + 2 I (aq)
이성질 화 반응
이성질체 화 반응에서, 화합물의 구조적 배열은 변화되었지만 순 원자 조성은 동일하게 유지된다.
예를 들면 :
ch 3 ch 2 ch 2 ch 3 (N- 부탄) → Ch 3 ch (ch 3 ) ch 3 (부탄)
가수 분해 반응
가수 분해 반응은 하나 이상의 물 분자가 물질에 첨가되는 반응이다. 어떤 경우에는 물질과 물 분자가 분할을 유발합니다. 가수 분해 반응의 일반적인 형태는 다음과 같습니다.
x (aq) + h 2 o (l) ↔ hx (aq) + oh (aq)
역 반응은 응축 반응입니다. 응축 반응에서 물이 물질에서 제거됩니다.
얼마나 많은 유형의 화학 반응이 있습니까?

기술적으로, 수백 또는 수천 가지의 다른 유형의 화학 반응이 있습니다. 그러나 화학 학생들은 일반적으로 4 가지 주요 유형, 5 가지 주요 유형 또는 6 개의 주요 유형으로 분류하는 법을 배웁니다. 화학적 반응의 4 가지 주요 유형은 합성, 분해, 단일 변위 및 이중 변위입니다. 그러나 어떤 사람들은 이러한 반응에 대해 다른 이름을 사용하십시오. 다른 중요한 유형의 반응은 연소, 산-염기 및 산화 환원 반응입니다. 많은 반응이 특별한 이름을 가진 유기 화학에서 훨씬 더 복잡해집니다. 그러나 이러한 다른 유형의 반응은 네 가지 주요 범주 중 하나에도 적합합니다!
화학 반응의 유형 워크 시트
이 워크 시트로 4 가지 주요 화학 반응을 식별하십시오. PDF 워크 시트 및 답변 키를 다운로드하여 인쇄하십시오.
[ 유형의 화학 반응 워크 시트 ] [ PDF 답변 키 ]
참조
- Atkins, Peter W.; Julio de Paula (2006). 물리 화학 (제 4 판). 와인 하임 :와일리 -VCH. ISBN 978-3-527-31546-8.
- iupac (1997). "화학 반응". 화학 용어의 개요 (제 2 판) (“골드 북”). doi :10.1351/goldbook.c01033
- Myers, Richard (2009). 화학의 기초 . 그린 우드 출판 그룹. ISBN 978-0-313-31664-7.
- Wiberg, Egon; Wiberg, Nils; 홀먼, 아놀드 프레드릭 (2001). 무기 화학 . 학업 언론. ISBN 978-0-12-352651-9.