이론적 수율 화학 반응의 것은 반응물이 완전히 반응하면 얻는 제품의 양입니다. 다음은 이론적 수율을 계산하는 단계와 작업 예제 문제와 함께 다음과 같습니다.
이론적 수율을 계산하는 단계
- 반응에 대한 균형 화학 방정식을 작성하십시오.
- 제한 반응물을 식별하십시오.
- 반응물을 제한하는 그램을 두더지로 변환합니다.
- 제한 반응물과 생성물 사이의 두더지 비율을 사용하고 이론적 인 곱을 찾으십시오.
- 제품 몰 수를 그램으로 변환합니다.
때로는 이러한 단계를 알아낼 필요 없이이 단계 중 일부를 알 수 있습니다. 예를 들어, 균형 방정식을 알고 있거나 제한 반응물이 제공 될 수 있습니다. 예를 들어, 하나의 반응물이 "초과"인 경우, 다른 반응물이 제한 반응물이라는 것을 알 수 있습니다.
이론적 수율 예제 문제
염소산 칼륨 가열 (kclo 3 가있는 다음 반응을 살펴 보겠습니다. ) 산소 가스를 생산합니다 (O 2 ) 및 염화 칼륨 (KCl).
2 kclo 3 (s) → 3 o 2 (g) + 2 kcl (s)
이 반응은 산소 가스를 얻는 비교적 저렴한 방법이기 때문에 학교 실험실에서 상당히 흔합니다.
균형 반응은 2 몰의 kclo 3 를 보여준다 3 몰의 o 2 를 생성합니다 및 2 몰의 KCl. 이론적 수율을 계산하기 위해이 비율을 전환 계수로 사용합니다. 다음은 일반적인 예제 문제입니다.
질문 : 735.3 그램의 Kclo
문제는 균형 방정식을 제공하고 제한 반응물 (이 경우 유일한 반응물)을 식별하므로 이제 KCLO 3 의 두더지 수를 알아야합니다. . 그램 kclo 3 를 변환하여이를 수행하십시오 Moles kclo 3 . 이것을 더 쉽게하기 위해, kclo 3 의 분자 질량을 아십시오. 122.55 g/mol.
입니다
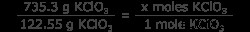

6 =x Moles kclo 3
화학 방정식을 사용하여 Moles Kclo 3 를 연관시킵니다 MOLES O 2 . 이것은 두 화합물 사이의 두더지 비율입니다. 우리는 2 몰의 Kclo 3 를 볼 수 있습니다 3 몰의 o 2 를 생성합니다 가스. 두더지 비율을 사용하고 6 몰의 염소산 칼륨에 의해 형성된 산소의 몰 수를 찾으십시오.



x 몰스 O 2 =3 x 3 몰 O 2
x 몰스 O 2 =9 몰 O 2
KClo
기술적으로 이것은 이론적 수율이지만, 두더지를 그램으로 변환 할 때 대답이 더 유용 해집니다. 산소의 원자 질량과 분자 공식을 사용하여 전환을 사용하십시오. 주기율표에서 산소의 원자 질량은 16.00입니다. 각각의 O 2 에는 2 개의 산소 원자가있다 분자.
x 그램 o 2 =(2) (16.00 그램 o 2 /두더지)
x 그램 o 2 =32 g/mol
마지막으로, 이론적 수율은 몰스-그램 전환 계수를 곱한 산소 가스의 두부 수입니다.
o 2 의 이론적 수율 =(9 몰) (32 그램/몰)
o 2 의 이론적 수율 =288 그램
제품을 만드는 데 필요한 반응물을 계산합니다
이론적 수율 계산의 변화는 미리 정해진 양의 제품을 원할 때 얼마나 많은 반응물을 사용하는지 찾는 데 도움이됩니다. 여기서 다시 균형 방정식으로 시작하여 반응물과 제품 사이의 두더지 비율을 사용하십시오.
.질문 : 90 그램의 물을 생산하기 위해 몇 그램의 수소 가스와 산소 가스가 필요합니까?
1 단계 :균형 방정식을 작성하십시오.
불균형 방정식으로 시작하십시오. 수소 가스 및 산소 가스 반응, 물 생산 :
H 2 (g) + o 2 (g) → H 2 o (l)
방정식 균형은 두더지 비율을 생성합니다.
2 h 2 (g) + o 2 (g) → 2 h 2 o (l)
2 단계 :제한 반응물을 식별합니다.
이 경우 반응을 거꾸로 작업하기 때문에 제품 (물)의 양이 한계입니다.
3 단계 :반응물 제한 그램을 몰로 변환합니다.
Moles H 2 o =(90 그램 H 2 o) (1 몰 h 2 O/18.00 그램 H 2 영형)
Moles H 2 O =5 몰
4 단계 :두더지 비율을 사용하십시오.
균형 방정식에서 H 2의 두더지의 수 사이에 1 :1 몰 관계가 있습니다. 및 H 2 O. 그래서 5 몰의 물은 5 몰의 수소 반응에서 비롯됩니다.
그러나 O 2 의 두더지 사이에는 1 :2 비율이 있습니다. 및 H 2 O. 물의 몰에 비해 산소 가스 몰의 절반이 필요합니다.
Moles o 2 =(두더지 비율) (몰스 물)
Moles o 2 =(1 mol o 2 /2 mol H 2 O) (5 mol H 2 영형)
Moles o 2 =2.5 mol
5 단계 :몰을 그램으로 변환합니다.
그램 H 2 =(Moles H 2 ) (2 g H 2 /1 mol H 2 ))
그램 H 2 =(5 몰 h 2 ) (2 g H 2 /1 mol H 2 ))
그램 H 2 =(5 몰 h 2 ) (2 g H 2 /1 mol H 2 ))
그램 H 2 =10 그램
그램 o 2 =(Moles o 2 ) (32 g o 2 /1 mol o 2 ))
그램 o 2 =(2.5 mol o 2 ) (32 g o 2 /1 mol o 2 ))
그램 o 2 =80 그램
따라서 90 그램의 물을 만들려면 10 그램의 수소 가스와 80 그램의 산소 가스가 필요합니다.
참조
- Petrucci, R.H., Harwood, W.S.; 청어, F.G. (2002) 일반 화학 (8th ed.). 프렌 티스 홀. ISBN 0130143294.
- Vogel, A.I.; Tatchell, A. R.; Furnis, B.S.; Hannaford, A. J.; Smith, P. W. G. (1996) Vogel의 실용적인 유기 화학 교과서 (5th ed.). 피어슨. ISBN 978-0582462366.
- Whitten, K.W., Gailey, K.D; 데이비스, R.E. (1992) 일반 화학 (제 4 판). 손더스 칼리지 출판. ISBN 0030723736.