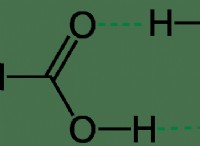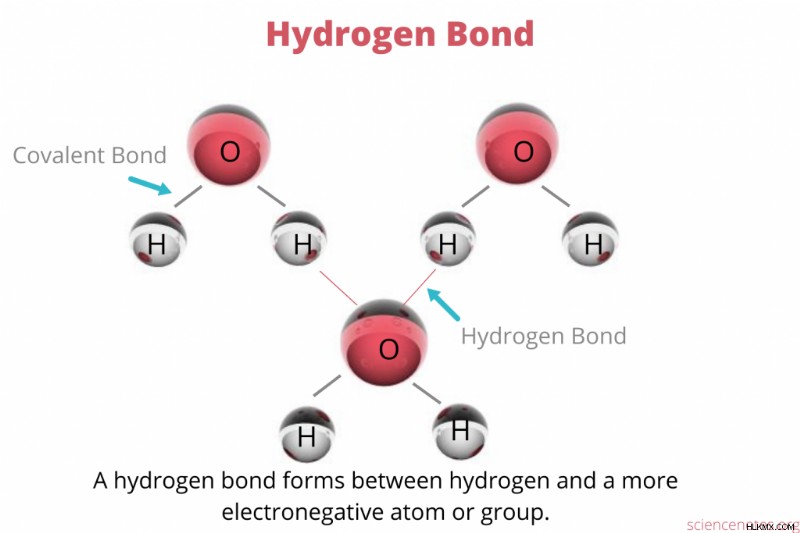
수소 결합 정의
수소 결합 하나의 분자에서 부분적으로 양성 하전 된 수소 원자와 동일하거나 다른 분자에서 부분적으로 네거티브 하전 된 원자 사이의 매력적인 쌍극자-디포 상호 작용이다. 이름에서 알 수 있듯이, 수소 결합은 항상 수소 원자를 포함하지만 다른 원자는 더 이상 전기 음성 요소 일 수 있습니다. 대부분의 수소 결합은 수소 (H)와 산소 (O), 불소 (F) 또는 질소 (N) 사이에 형성됩니다.
요구 사항
수소 결합은 화학 결합에 이미 참여하는 원자를 포함하기 때문에 반 직관적 인 것 같습니다. 당신이 이해해야 할 것은 결합에 있다고해서 원자의 전자 특성을 바꾸지 않는다는 것입니다. 본드는 다른 원자에 대한 매력을 취소하지 않습니다. 수소 결합이 발생하려면 두 가지 조건을 충족해야합니다.
- 전기 음성 원자는 작아야합니다. 원자의 크기가 작을수록 정전기 인력이 커집니다. 따라서 불소는 요오드보다 수소 결합을 형성하는 데 더 좋습니다.
- 수소 원자는 고도로 전기 음성 원자에 결합되어야합니다. 전기 음성이 클수록 분극이 강해집니다. 따라서 산소에 결합 된 수소는 탄소에 결합 된 수소 결합보다 수소 결합을 더 형성 할 수 있습니다.
수소 결합 강도
화학적 결합이 진행됨에 따라 수소 결합은 그다지 강하지 않습니다. 결합 에너지는 1 내지 40 kcal/mol 사이입니다. 그것들은 공유 결합보다 약합니다 (이온 결합보다 약한). 수소 결합은 공유 O-H 결합의 강도의 약 5%입니다. 수소 결합은 반 데르 발스 세력보다 강합니다.
수소 결합의 유형
두 가지 유형의 수소 결합은 분자 내 수소 결합 및 분자간 수소 결합입니다.
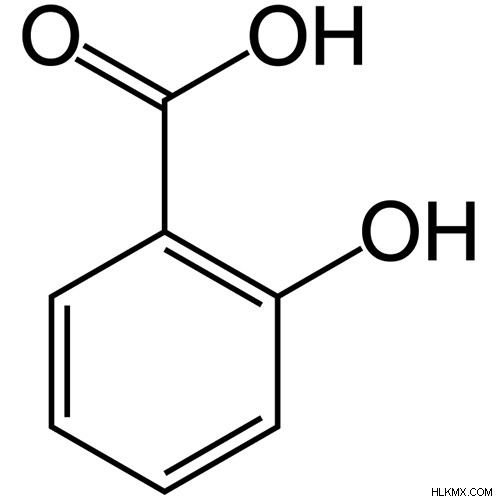
- 분자 내 수소 결합 - 분자 내 수소 결합은 단일 분자 내에서 발생합니다. 이것은 분자의 두 기능 그룹이 배열되어 서로를 끌 수있는 경우에 발생합니다. 살리실산에서 예를 들었다. 고리의 알코올 (-OH) 그룹은 카르 복실 산 그룹 (이중 결합 산소)을 끌어냅니다. 분자간 수소 결합은 또한 DNA 염기 쌍 사이에서 발생합니다.
- 분자간 수소 결합 - 분자간 수소 결합은 두 분자의 원자 사이에서 발생합니다. 이것은 하나의 분자가 부분적으로 양성 수소 원자를 함유하고 다른 분자는 부분적으로 음의 원자를 함유 할 때 발생합니다. 이러한 유형의 결합은 물 분자 사이에서 발생합니다. 또한 물과 알코올과 Aldehyde 사이에서 발생합니다.
수소 결합의 예
무기 및 유기 분자 모두 수소 결합에 참여합니다. 다음은 몇 가지 예입니다.

- Hydrofluoric 산 (HF) :히드로 플루오산은 대칭 수소 결합이라고 불리는 것을 형성하며, 여기서 양성자는 두 개의 동일한 원자 사이의 중간에 간격을두고있다. 대칭 수소 결합은 일반 수소 결합보다 강합니다. 공유 결합의 강도와 비슷합니다.
- 암모니아 (nh 3 ) :분자간 수소 결합은 한 분자의 수소와 다른 분자의 질소 사이에 형성됩니다. 암모니아의 경우, 각 질소에는 하나의 고독한 전자 쌍이 있기 때문에 형성되는 결합은 매우 약합니다. 질소와의 이러한 유형의 수소 결합은 메틸 아민에서도 발생합니다.
- 아세틸 아세톤 (c 5 H 8 o 2 ) :수소와 산소 사이에서 분자 내 수소 결합이 발생합니다.
- DNA : 수소 결합은 기본 쌍 사이에 형성됩니다. 이것은 DNA가 이중 나선 모양을 제공하고 수소 결합을 따라“질을 감지”하기 때문에 가닥의 복제를 가능하게합니다. .
- 나일론 : 수소 결합은 중합체의 반복 단위 사이에서 발견됩니다.
- 단백질 : 분자 내 수소 결합은 단백질 폴딩을 초래하여 분자가 안정성을 유지하고 기능적 구성을 가정하는 데 도움이됩니다.
- 중합체 : 카르 보닐 또는 아미드 그룹을 함유하는 중합체는 수소 결합을 형성한다. 예는 우레아 및 폴리 우레탄 및 천연 중합체 셀룰로오스를 포함한다. 이 분자의 수소 결합은 인장 강도와 융점을 증가시킵니다.
- 알코올 : 에탄올과 다른 알코올은 수소와 산소 사이의 수소 결합을 포함합니다.
- 클로로포름 (chcl 3 ) :수소 결합은 한 분자의 수소와 다른 분자의 염소 사이에서 발생합니다.
수소 결합의 중요성
수소 결합은 지구 생활에 중요합니다. 물 분자 사이의 수소 결합은 큰 물 근처의 안정적인 온도를 유지하고, 인간이 땀을 통해 자신을 식히고 얼음을 떠 다니도록 도와줍니다. 결합은 DNA, 셀룰로오스 및 단백질과 같은 생체 분자에 중요합니다. 수소 결합은 약물 설계의 핵심입니다.
수소 결합의 흥미로운 효과
수소 결합은 몇 가지 흥미롭고 특이한 효과를 초래합니다.
- 용융 및 끓는점 - 일반적으로, 유사한 분자량의 물질은 유사한 용융 및 끓는점을 갖는다. 그러나 알코올은 비슷한 분자량의 에테르보다 비등점이 훨씬 높습니다. 알코올의 수소 결합은 수소 결합을 파괴하고 끓는 것을 허용하기 위해 여분의 에너지가 필요하기 때문에 끓는점을 증가시킵니다.
- 변동성 - 수소 결합을 경험하는 분자는 비등점이 높기 때문에 휘발성이 적습니다.
- 용해도 - 수소 결합은 알코올이 물에 용해되는 이유를 설명하지만 알칸은 그렇지 않습니다. 알코올에서 분자간 수소 결합을 통해 물과 수소 결합을 형성 할 수 있습니다. 비극성 알칸은 이러한 유대를 형성 할 수 없습니다. 그러나 알코올에서 탄소 사슬의 길이를 증가 시키면 사슬이 수소 결합 형성을 방해하기 때문에 용해도가 감소합니다.
- v iscosity and surface thension - 수소 결합은 영향을받는 분자의 흐름 능력을 감소시켜 점도와 표면 장력이 더 높습니다.
- 물보다 얼음 밀도 -수소 결합은 얼음에서 새장 같은 구조를 생성합니다. 대조적으로, 액체 물은 밀접하게 포장되지 않습니다. 따라서 얼음은 물보다 밀도가 낮습니다.
- 위상 변화 이상 - 수소 결합은 일부 화합물이 특정 온도에서 액체가되게 한 다음 온도가 증가함에 따라 고체로 고체 된 다음 다른 온도를지나 액체를 만듭니다.
- deliquescence -수산화 나트륨 (NAOH)은 OH가 공기 중의 수분과 반응하여 수소 결합 종을 형성하기 때문에 탈리 네시를 부분적으로 표시합니다. 다른 분자들과 비슷한 과정이 발생합니다.
- 자가 치유 중합체 -스마트 고무 및 기타자가 치유 폴리머는 수소 결합을 사용하여 찢어 질 때 "치유"합니다.
헤비어 수소 결합
헤비 워터 (수소의 동위 원소 인 중수소)를 갖는 수소 결합은 정상적인 물 (수소의 동위 원소가 삼중습 인 경우)보다 훨씬 강합니다. 삼 분쇄 된 물과 관련된 수소 결합은 더욱 강하다.
참조
- iupac (1997). "수소 결합". 화학 용어의 개요 (제 2 판) (“골드 북”). 블랙웰 과학 간행물 :옥스포드. ISBN 0-9678550-9-8. doi :10.1351/Goldbook
- Jeffrey, G. A.; Saenger, W. (2012). 생물학적 구조에서의 수소 결합 . 스프링거 :베를린. ISBN :3540579036.
- Sweetman, A.M.; Jarvis, S. P.; SANG, 홍키 인; Lekkas, I.; Rahe, P.; 왕, 유; Wang, Jianbo; Champness, N.R.; Kantorovich, L.; Moriarty, P. (2014). “수소 결합 조립체의 힘장 매핑”. 자연 통신 . 5 :3931. doi :10.1038/ncomms4931
- Weinhold, Frank; 클라인, 로저 A. (2014). “수소 결합은 무엇입니까? 초분자 도메인의 공명 공유”. 화학 교육 연구 및 실무 . 15 :276–285. doi :10.1039/c4rp00030g