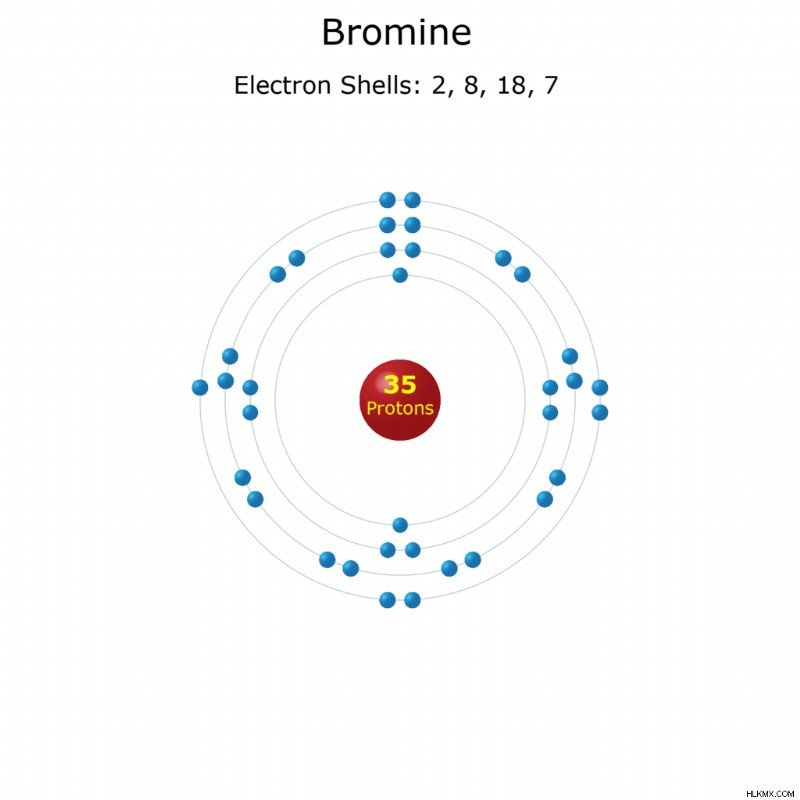
브롬은 주기율표에 원소 기호 BR이있는 원자 번호 35입니다. 실온 및 압력에서 액체 인 수은 이외의 유일한 요소입니다. 당신은 수영장과 불꽃 지연자에서 브롬을 만납니다. 다음은 유용하고 흥미로운 브롬 사실의 모음입니다.
기본 브로민 사실

이름 : 브롬
원자 번호 : 35
요소 기호 : br
그룹 : 그룹 17
기간 : 기간 4
블록 : p- 블록
요소 가족 : 할로겐
원자 질량 : [79.901, 79.907]; 기존 :79.904
전자 구성 : [AR] 3d 4S 4p
외관 : 적갈색 액체
발견 : Carl Jacob Löwig와 Antoine Balard는 각각 1825 년과 1826 년에 Bromine 요소를 발견했습니다. Löwig는 요소를 먼저 발견했지만 Balard는 자신의 결과를 먼저 발표했습니다. Löwig는 독일 Bad Kreuznach의 고향에서 가져온 미네랄 워터 스프링에서 요소를 분리했습니다. Balard는 프랑스 Montpellier의 소금 습지에서 가져온 해초 재에서 고립 된 브로민. 1825 년 독일 화학자 Justus von Liebig도 바닷물 샘플에서 갈색 액체를 분리했지만 Balard의 출판물을 알게 될 때까지 새로운 요소라는 것을 몰랐습니다.
.이름 원산지 : Balard는 소금물의 라틴어 단어에서 새로운 요소 Muride를 지명했습니다. . 그러나 그는 이름을 brôme 으로 바꿨습니다 그의 출판물에서“Stench”에 대한 그리스어 단어에서. 이름은 브롬 증기의 으스스한 냄새에서 나온 것입니다. 결국 요소 이름은 브롬으로 변경되어 -ine 을 사용했습니다. 할로겐 이름 접미사.
동위 원소 : 천연 브롬은 BR과 BR의 두 가지 안정적인 동위 원소로 구성됩니다. BR은 원소의 자연 풍부의 51%를 차지합니다. 수많은 방사성 동위 원소가 합성되었습니다. 가장 안정적인 동위 원소는 BR이며 반감기는 57.04 시간입니다.
풍부함 : Bromine은 지각에서 64 번째로 풍부한 요소로 2.4 mg/kg입니다. 그것은 바닷물에서 67.3 mg/L의 풍부한 10 번째 가장 풍부한 요소입니다. 상업적으로 브롬은 이스라엘, 미국 및 중국의 브롬 풀에서 추출됩니다.
생물학적 역할 : 염소와 마찬가지로 원소 브롬은 화학 물질 화상을 피부에 유발하는 독성 물질입니다. 흡입은 고농도로 자극, 저농도 또는 사망으로 자극을 유발할 수 있습니다. 그러나 브롬은 동물의 필수 요소입니다. 브로마이드 이온은 콜라겐 합성의 보조 인자이다. 브롬은 또한 백혈구가 기생충을 죽이고 REM 수면에서 역할을하도록 도와줍니다. 브로마이드 화합물은 진정제 및 항 경련제로 사용되었다. 구체적으로, 브로마이드 나트륨과 칼륨 브로마이드는 19 세기에 염소 수화물로 대체 될 때까지 19 세기와 20 세기에 사용되었다.
사용 : 브롬은 많은 불꽃 지연 화합물에 사용됩니다. 브로마 화 된 화합물이 연소되면, 히드로브로 산이 생성된다. 산은 연소의 산화 반응을 방해함으로써 화염 지연제로서 작용한다. 브롬은 염소와 같은 수영장을 소독하는 데 사용됩니다. 브롬은 브롬화 플라스틱과 폴리머를 만드는 데 사용됩니다. Bromomethane은 살충제 훈증제입니다. 브로 모 클로로 메탄 및 브로 모트 리플 루오로 메탄과 같은 비 독성 할로 메탄 화합물은 잠수함 및 우주선에서 사용됩니다. 그러나 비싸고 오존층을 손상시키기 때문에 일반적으로 유용하지 않습니다. 브로민은 리드 연료에 사용되어 에틸렌 브로마이드 형태의 엔진 노크를 방지했습니다.
브롬 물리적 데이터
STP의 단계 : 액체
밀도 : br 2 액체 :3.1028 g/cm
용융점 : (br 2 ) 265.8 K (-7.2 ° C, 19 ° F)
끓는점 : (br 2 ) 332.0 K (58.8 ° C, 137.8 ° F)
임계점 : 588 K, 10.34 MPa
융합의 열 : (br 2 ) 10.571 kj/mol
기화의 열 : (br 2 ) 29.96 kj/mol
어금니 열 용량 : (br 2 ) 75.69 j/(mol · k)
원자 데이터
원자 반경 : 오후 120시
공유 반경 : 120 ± 3 pm
van der waals 반경 : 185 PM
전기 음성 : 폴링 스케일 :2.96
1 차 이온화 에너지 : 1139.9 kj/mol
2 차 이온화 에너지 : 2103 kj/mol
3 번째 이온화 에너지 : 3470 kj/mol
산화 상태 :-1 , +1 , +3 , +4, +5 , +7
결정 구조 : 춘계
자기 순서 : diamagnetic
흥미로운 브롬 사실
- 브로마이드는 -1 산화 상태에서 브롬을 함유하는 화합물이다. 이것이 브로민과 다른 할로겐의 가장 일반적인 상태이지만 유일한 상태는 아닙니다.
- brominated 식물성 기름은 감귤 향이 소다에서 분리되는 것을 막는 식품 첨가제입니다. 장기 노출은 신경 학적 증상을 유발합니다. 유럽에서는 사용이 금지되어 있지만 미국에서는 금지되어 있습니다.
- Tyrian Purple이라고 불리는 고대 왕실 자주색 염료는 브롬 화합물입니다.
- Bromothymol Blue는 Bromine 기반 pH 지표입니다.
- Dow Chemical Company는 Herbert Dow가 Bromine을 미국 중서부의 소금물에서 분리했을 때 시작했습니다.
- Xylyl Bromide 및 관련 브롬 화합물은 1 차 세계 대전에서 독 가스로 사용되었습니다.
참조
- duan, defang; et al. (2007-09-26). “ ab initio 고압 하에서 고체 브롬에 대한 연구”. 물리적 검토 b . 76 (10) :104113. doi :10.1103/physrevb.76.104113
- Greenwood, Norman N.; Earnshaw, Alan (1997). 요소의 화학 (제 2 판). Butterworth-Heinemann. ISBN 0-08-037941-9.
- Haynes, William M., ed. (2011). 화학 및 물리학의 CRC 핸드북 (92 번째 ed.). Boca Raton, FL :CRC Press. ISBN 1439855110.
- Weast, Robert (1984). CRC, 화학 및 물리학 핸드북. 플로리다 주 보카 라톤 :화학 고무 회사 출판. ISBN 0-8493-0464-4.
- 주, Mary Elvira (1932). “요소의 발견 :XVII. 할로겐 가족”. 화학 교육 저널 . 9 (11) :1915. doi :10.1021/ed009p1915