우라늄은 원자 번호 92 및 요소 기호 U를 갖는 방사성 요소입니다.이 회색 금속은 탄약, 갑옷, 핵무기 및 원자력 발전소에 사용됩니다. 다음은 요소의 발견, 용도, 출처 및 독성을 포함한 흥미로운 우라늄 사실 모음입니다.
우라늄 요소 사실
이름 : 우라늄
원자 번호 : 92
요소 기호 : u
원자 무게 : 238.02891 (3)
외관 : 은빛 회색 금속
기간 : 기간 7
블록 : f- 블록
요소 가족 : 액티 나이드
전자 구성 : [rn] 5f 6d 7s
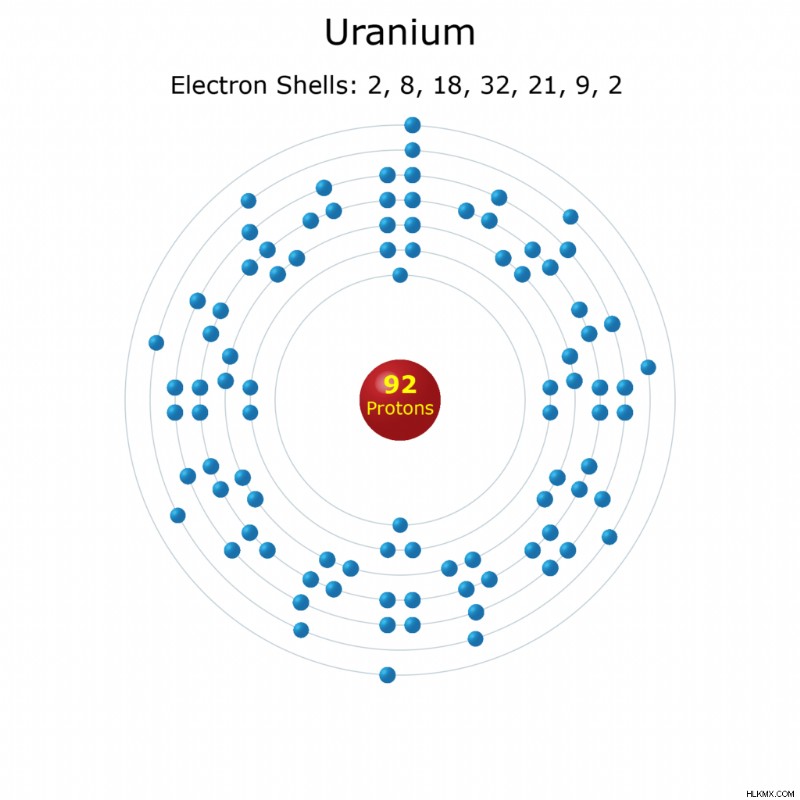
쉘 당 전자 : 2, 8, 18, 32, 21, 9, 2
발견 : Martin Klaproth (1789)
이름 원산지 : 행성 천왕성
발견의 역사

우라늄이 요소로서 발견되기 전에, 산화물은 적어도 79 년부터 노란 세라믹 안료로 로마인들에 의해 사용되었습니다. 중세 시대에 Pitchblende는 유리 색상으로 사용되었습니다.
독일 화학자 인 Martin Heinrich Klaproth는 1789 년에 우라늄을 발견했습니다. Klaproth는 질산에 Pitchblende를 용해시키고 수산화 나트륨으로 용액을 중화시켜 황색 화합물을 얻었습니다. 그는이 화합물이 새로운 요소의 산화물이라고 믿었습니다. 그는 천왕성의 이름을 지명했습니다.
1841 년, 프랑스 화학자 Eugène-Melchior Péligot는 우라늄을 최초로 분리 한 사람이되었습니다. 그는 칼륨으로 우라늄을 가열하여 금속을 얻었습니다.
우라늄 동위 원소
모든 우라늄 동위 원소는 방사성입니다. 자연 요소는 우라늄 -238 (99.28%), 우라늄 -235 (0.71%) 및 우라늄 -234 (0.0054%)의 세 가지 동위 원소로 구성됩니다. 이 동위 원소는 알파 입자를 방출하고 자발적 핵분열의 확률이 적습니다. 5 개의 다른 동위 원소는 방사성 붕괴 및 중성자 캡처로부터 미량 양으로 자연적으로 발생합니다. 우라늄 -238은 가장 안정적인 동위 원소이며, 반감기는 약 4.468 × 10 세 (대략 지구의 나이)입니다.
"강화 된"우라늄은 가공 된 우라늄으로 3% ~ 5% 우라늄 -235로 구성됩니다. 이 동위 원소의 양을 늘리면 우라늄이 더 핵분열 가능합니다. 우라늄은 가스 원심 분리기를 사용하여 풍부합니다. 여기서 우라늄 헥사 플루오 라이드 (uf 6 ) 원심 분리기의 가스는 은색 inc 막을 통한 확산에 의해 분리된다. uf 6 이후 uf 6 보다 약간 무겁습니다 , 그것은 더 천천히 확산되므로 막을 통과하는 가스가 원하는 동위 원소에서 약간 더 풍부 해집니다. 우라늄 농축의 다른 방법은 액체 열 확산 및 원자 증기 레이저 동위 원소 분리 (AVLIS)를 포함합니다.
생물학적 역할과 독성
우라늄은 동물에서 알려진 생물학적 기능을 제공하지 않습니다. 요소는 방사능뿐만 아니라 사람들에게도 유독합니다. 알파 입자가 짧은 범위에 걸쳐 작용하고 피부에 침투 할 수 없기 때문에 방사선 효과는 주로 국소 (일반적으로 폐에)입니다. 요소의 독성은 생식계, 뇌, 심장, 간 및 신장에 영향을 미칩니다. 또한 일부 우라늄 붕괴 제품은 독성 및 방사성입니다. 금속은 흡입되거나 섭취되지 않도록주의를 기울이는 한 안전하게 처리 될 수 있습니다. 우라늄 화합물은 독성입니다.
우라늄은 대부분의 유기체에 유해하지만, 일부 박테리아는 요소의 산화 상태를 U (vi)에서 U (iv)로 전환하여 성장을위한 에너지를 얻습니다. 이 종에는 shewanella putrefaciens 가 포함됩니다 , geobacter metallireducens 및 Burkholderia 곰팡이 . 박테리아 시트로 박터 그리고 이끼 trapelia involuta 고농도의 우라늄을 흡수 할 수 있습니다.
우라늄의 공급원
우라늄 (및 철보다 큰 원자 수의 모든 자연 요소)은 초신성 및 중성자 별 합병의 빠른 중성자 캡처 (R- 프로세스)에서 형성됩니다. 지구의 우라늄의 대부분은 원시적이며 (행성이 형성 될 때) 소량은 플루토늄과 큐륨의 방사성 붕괴에 의해 생성됩니다.
우라늄은 지각에서 상당한 양으로 발견되는 가장 높은 원자 수 요소입니다. 그것은 51 번째로 가장 풍부한 요소이며 2 ~ 4 ppm의 농도에서 물, 토양 및 암석에서 발생합니다. 은보다 약 40 배 더 풍부합니다.
요소는 우라 닌 나이트, 카르노 타이트, 우라 노 파네, 오타나이트, 관 및 토르 나이트를 포함한 많은 미네랄에서 발생합니다. 우라늄 채굴은 카자흐스탄, 캐나다, 호주, 니제르, 나미비아 및 러시아에서 발생합니다.

우라늄 사용
우라늄은 많은 용도를 가지고 있습니다.
- 우라늄은 도자기 유약, 황색 유리 및 바셀린 유리를 만드는 데 사용됩니다. 한 번에, 그것은 축제에 사용되었습니다.
- 그것은 양모와 실크 염색의 모르 드로 사용됩니다.
- 질산 우라늄은 사진 토너입니다.
- 그것은 트랜 uranium 요소를 만드는 데 사용됩니다.
- 우라늄 -238은 플루토늄 -239를 만드는 데 사용됩니다.
- 핵무기를 만드는 데 사용됩니다.
- 우라늄은 원자력 발전소에서 연료로 사용됩니다.
- 고갈 된 우라늄 (우라늄 235의 우라늄)
- 우라 닐 아세테이트 및 우라 닐 포르 메이트는 투과 전자 현미경을 위해 시편을 염색하는 데 사용됩니다.
- 반감기가 길기 때문에 우라늄 -238은 화성암의 나이를 추정하는 데 사용됩니다.
- 우라늄은 고 에너지 X- 방사선을 생성하기 위해 X- 선 목표로 사용됩니다.
우라늄 화합물
우라늄은 여러 산화 상태를 가지며 산화물, 수용성 염 (화려한 용액), 탄산염, 질화물, 탄화물 및 수 소화물을 포함한 많은 화합물을 형성합니다. 옐로 케이크는 우라늄 산화물의 혼합물에 주어진 이름입니다. 우라늄은 항상 순수한 순수 금속이 아닌 화합물에서 발생합니다.
물리적 데이터
밀도 (실내 온도) : 19.1 g/cm
용융점 : 1405.3 K (1132.2 ° C, 2070 ° F)
끓는점 : 4404 K (4131 ° C, 7468 ° F)
20ºC의 상태 : 단단한
융합의 열 : 9.14 kj/mol
기화의 열 : 417.1 kj/mol
어금니 열 용량 : 27.665 J/(mol · K)
열 확장 : 13.9 µm/(m · k) (25 ° C)
열전도율 : 27.5 w/(m · k)
결정 구조 : 춘계
자기 순서 : 상자성
원자 데이터
원자 반경 : 경험적 :156 pm
공유 반경 : 196 ± 7 pm
van der waals 반경 : 186 PM
전기 음성 : 폴링 스케일 :1.38
1 차 이온화 에너지 : 597.6 kj/mol
2 차 이온화 에너지 : 1420 kj/mol
산화 상태 : +1, +2, +3, +4, +5, +6 (양서류 산화물)
흥미로운 우라늄 사실
- Henri Becquerel은 1896 년 근처에 저장된 우라늄 노출 사진 판의 샘플을 발견했을 때 방사능을 발견했습니다.
- 우라늄은 열성적입니다. 우라늄 금속 과립은 실온에서 공기 중에 자발적으로 점화됩니다.
- 대부분의 금속과 마찬가지로 우라늄은 가단성과 연성입니다. 많은 금속과 달리 전기 도체가 좋지 않습니다.
- 새로 준비된 우라늄 금속은 은색이지만 공기 중에 빠르게 산화되어 어두워집니다.
- 우라늄 1 킬로그램의 완전한 핵분열 -235 이론적으로 최대 20 개의 테라 줄의 에너지를 생산하며, 이는 150 만 킬로그램의 석탄만큼 에너지입니다.
- 우라늄 금속에는 3 개의 동반자 (결정 형태)가 있습니다. 알파 동종 트로프는 사방 정하이며 최대 668 ° C까지 안정합니다. 정각 베타 동반자는 668 ° C에서 775 ° C의 온도에서 발생합니다. 775 ° C에서 요소의 용융점까지 감마 형태가 발생합니다. 감마 할당은 신체 중심 입방 구조를 가지고 있으며 가장 가단성 있고 연성 형태의 금속입니다.
- 우라늄의 생식 시스템에 미치는 영향으로 인해 우라늄 광부는 여성 자녀를 가질 가능성이 더 높습니다.
참조
- Emsley, John (2001). "우라늄". 자연의 빌딩 블록 :요소에 대한 A ~ Z 가이드 . 옥스포드 :옥스포드 대학 출판부. 476–482 쪽. ISBN 978-0-19-850340-8.
- Morss, L.R.; Edelstein, N.M.; Fuger, J., eds. (2006). Actinide 및 Transactinide 원소의 화학 (제 3 판). 네덜란드 :스프링거. ISBN 978-9048131464. doi :10.1007/1-4020-3598-5_5
- Seaborg, Glenn T. (1968). "우라늄". 화학 요소의 백과 사전 . Skokie, Illinois :Reinhold Book Corporation. pp. 773–786. LCCCN 68-29938.