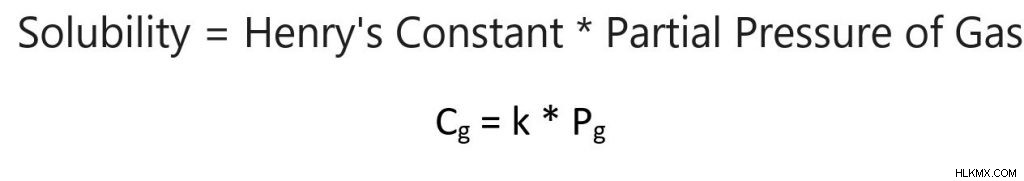소다 캔을 열면 Henry의 법칙의 예가 들립니다. 캔을 열면 이산화탄소의 압력이 빠르게 감소합니다. Henry의 법칙에 따르면 음료의 이산화탄소 농도도 감소 할 것입니다. 당신이 듣는 소리는 액체에서 탈출하는 이산화탄소입니다. 아래 Henry의 법칙에 대해 자세히 알아보십시오.
헨리의 법은 무엇입니까?
Henry의 법칙은 액체 위의 가스의 부분 압력과 액체에 용해 된 가스 사이의 관계를 설명합니다. 일반적으로, 압력이 높을수록 더 많은 가스가 액체에 용해됩니다. 이 관계는 다음 방정식으로 설명됩니다.
용해도 =Henry의 일정한 * 가스의 부분 압력
c g =kp g
c g =용해 된 가스의 농도
k =헨리의 상수
p g =가스의 부분 압력
방정식의 상수는 검사중인 가스에 의존합니다. 방정식은 예와 함께 아래의 MOR 세부 사항으로 설명합니다.
법은 여러 가스가있는 경우에도 사용할 수 있습니다. 대기 화학 및 환경 연구는 대기와 물 시스템 사이를 오가는 가스를 조사 할 때 일반적으로 Henry의 법칙을 활용합니다.
Henry 's Law Constant
헨리 법의 상수는 실험을 통해 결정됩니다. 액체 위의 가스 압력을 조심스럽게 제어 한 다음 용액의 농도를 측정합니다. 상수는 농도를 다른 지점에서 부분 압력으로 나누어 실험적으로 결정됩니다.
.상수의 단위는 일반적으로 mol*m*pa이며, 이는 mol*l*atm과 동일합니다. 분수 형태 로이 단위는 다음과 같이 나타납니다.
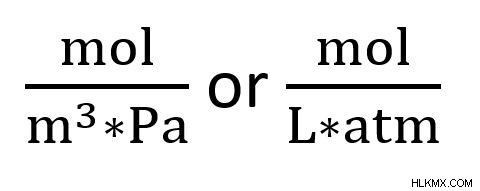
Henry 's Law Constants 목록
아래는 물 속의 일반적인 가스에 대한 Henry의 법률 상수 목록입니다. 이 백서에서보다 완전한 목록을 찾을 수 있으며 아래에 나열된 상수의 소스입니다. 이 링크에서 위의 논문을 기반으로 검색 가능한 상수 데이터베이스도 있습니다.
| 물의 가스 | Henry 's Law Constant (Mol*m*pa) | Henry 's Law Constant (mol*l*atm) |
| 수소 브로마이드 (HBR) | 0.24 | 24.3 |
| 과염소산 (Hclo 4 ) | 9.9 * 10 | 1.0 * 10 |
| 불소 (HF) | 1.3 * 10 | 1.32 * 10 |
| nitric acid (hno 3 ) | 2.1 * 10 | 2.12 * 10 |
| 수소 (H 2 ) | 7.7 * 10 | 7.8 * 10 |
| 중수소 (d 2 ) | 7.9 * 10 | 8.0 * 10 |
| 산소 (O 2 ) | 1.2 * 10 | 1.2 * 103 |
| Bromine (br 2 ) | 7.2 * 10 | 0.73 |
| 이산화황 (So 2 ) | 1.2 * 10 | 1.22 |
| 메탄 (ch 4 ) | 1.4 * 10 | 1.41 * 10 |
| 벤젠 (c 6 H 6 ) | 1.8 * 10 | 0.18 |