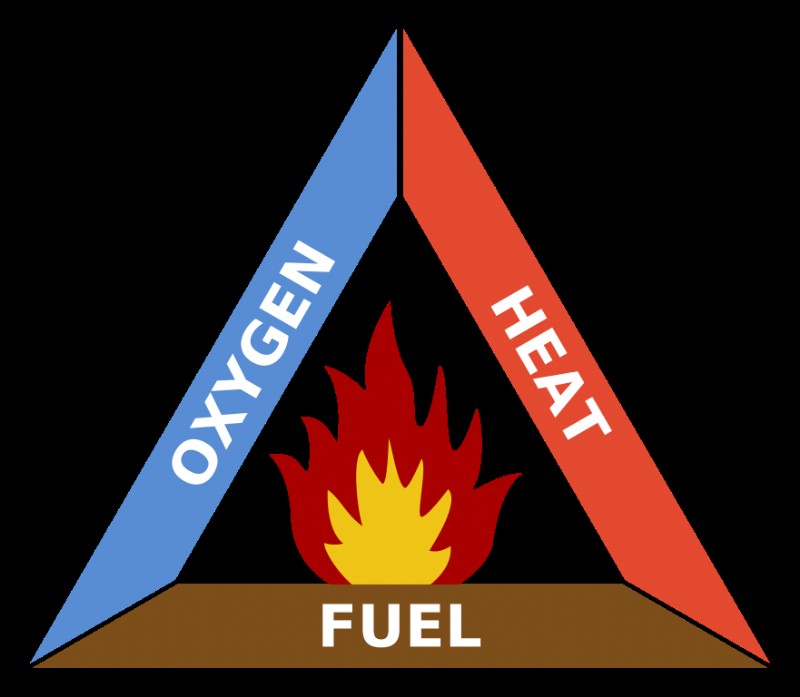
연소 반응은 연료와 산화 된 생성물을 형성하는 산화제 사이의 발열 화학 반응이다. 일반적인 화학에서는 주요 화학 반응의 주요 유형 중 하나입니다. 연소는 탄화수소 연료 (예를 들어, 석탄, 프로판, 목재, 메탄)와 분자 산소 (O 2 사이의 반응입니다. ), 이산화탄소 생산 (Co 2 ), 물 (H 2 o) 및 열. 열은 화학 반응을 시작하기 위해 활성화 에너지를 제공합니다. 산소, 연료 및 열의 조합은 화재 삼각형을 형성합니다 , 이것은 연소 요구 사항을 나타내는 한 가지 방법입니다.
일반 연소 반응 방정식의 일반적인 형태
연소 반응의 일반적인 형태는 다음과 같습니다.
탄화수소 + 산소 → 이산화탄소 + 물 + 열
c x h y + o 2 → Co 2 + h 2 o
연소 반응의 예
연소를 불타는 것도라고도합니다. 따라서, 당신이 생각할 수있는 화상의 예는 타는 경기, 양초, 캠프 파이어 및 가스 버너를 포함한 연소 반응입니다. 다음은 연소 반응을위한 균형 방정식의 예입니다.
- 메탄의 연소
ch 4 (g) + 2 o 2 (g) → Co 2 (g) + 2 H 2 o (g) - 나프탈렌의 연소
c 10 H 8 + 12 o 2 → 10 Co 2 + 4 h 2 o - 에탄의 연소
2 C 2 H 6 + 7 o 2 → 4 Co 2 + 6 h 2 o - 부탄의 연소 (라이터에서 일반적으로 발견)
2c 4 H 10 (g) +13o 2 (g) → 8co 2 (g) +10H 2 o (g) - 메탄올 연소 (목재 알코올이라고도 함)
2ch3 오 (g) + 3o 2 (g) → 2co 2 (g) + 4H 2 o (g) - 프로판 연소 (가스 그릴, 벽난로 및 일부 쿡 스토브에 사용)
2c 3 H 8 (g) + 7o 2 (g) → 6co 2 (g) + 8h 2 o (g)
연소 반응을 인식하는 방법
탄화수소 (탄소 및 수소 함유 분자)와 산소 가스 (O 2 를 볼 때 연소 반응이 있음을 알게 될 것입니다. ) 반응 화살표의 반응물 쪽 (왼쪽)에서 화살표 및 이산화탄소 (Co 2 ) 및 물 (H 2 o) 반응 화살표의 제품 측 (오른쪽). 또한 산소를 사용한 연소는 항상 열을 발생시킵니다. 반응은 여전히 활성화 에너지가 시작되어야하지만 시작하는 것보다 연소에 의해 더 많은 열이 방출됩니다.
많은 연소 반응은 불꽃을 생성합니다. 화재가 보이면 연소 반응을 나타냅니다. 그러나 연소는 종종 화재없이 발생합니다. 예를 들어, 연기는 화염이없는 연소입니다.
반응물에 자체 산화제 (산소)가 포함되어 있거나 연소가 불완전하기 때문에 이산화탄소 및 물 외에 다른 제품을 형성하기 때문에 연소 반응을 인식하기가 더 어렵습니다. 예를 들어, 일부 로켓은 Aerozine 50 (c 2 사이의 반응에 의존합니다. H 12 n 4 ) 및 질소 테트 록 사이드 (n <<서브> 2 o 4 ). 영리하다면 Aerozine 50에는 연료 (탄소-하이드로겐 및 탄소 질소) 역할을하는 데 필요한 화학적 결합이 포함되어있어 연소를위한 질소 테트 록 사이드 공급 산소가 포함되어 있습니다.
.그런 다음 산소와 관련이없는 형태의 연소가 있습니다.
산소가없는 연소
기술적으로 산화에는 항상 산소가 필요하지 않으므로 산소없이 연소가 발생할 수 있습니다.
산화제는 일반적으로 화학 반응에 산소를 공급함으로써 전자를 받아들입니다. 다른 산화제에는 할로겐 (불소, 염소 등)이 포함됩니다. 금속성 연료는 불소 폴리머 (예 :Teflon, Viton)를 사용하여 화상을 입히고, 산소가 전혀 없을 필요없이.
.완료 대 불완전한 연소
다른 화학 반응과 마찬가지로 연소는 제한 반응물의 대상이되며 항상 완료되지는 않습니다.
- 완전한 연소 또는 "청정 연소"는 탄화수소의 산화가 이산화탄소와 물만 생성 할 때 발생합니다. 불타는 촛불 왁스는 완전한 연소의 좋은 예입니다. 불타는 심지로부터의 가열은 왁스 (탄화수소)를 기화시킨다. 왁스는 산소와 반응하여 이산화탄소와 물을 방출합니다. 왁스는 화상을 입히고 이산화탄소와 물이 공기로 소실됩니다.
- 불완전한 연소 또는 "더러운 연소"는 불완전한 탄화수소 산화로, 이산화탄소 및 물 외에 일산화탄소 (CO), 탄소 (수트) 및 기타 제품을 생성합니다. 목재와 대부분의 화석 연료는 불완전한 연소를 겪고 이러한 추가 폐기물을 방출합니다.
참조
- 부족, 막시밀리안; 겨울, 프란츠; Agarwal, Avinash K., eds. (2010). 연소 핸드북 . 와일리 -VCH. ISBN 978-3-527-32449-1.
- 법, C.K. (2006). 연소 물리학 . 케임브리지 대학교 출판부. ISBN 9780521154215.
- Schmidt-Rohr, K (2015). “연소가 항상 발열되는 이유 O 2 의 두더지 당 약 418 kJ를 산출합니다. ". j. 화학 교육 . 92 (12) :2094–2099. doi :10.1021/acs.jchemed.5B00333