화학 방정식 반응에서 반응물 및 생성물을 반응하고 반응이 진행되는 방향을 나타내는 화학 반응의 상징적 표현이다. 프랑스 화학자 Jean Beguin
다음은 화학 방정식의 유형, 포함 된 부분 및 예제에 대한 설명입니다.
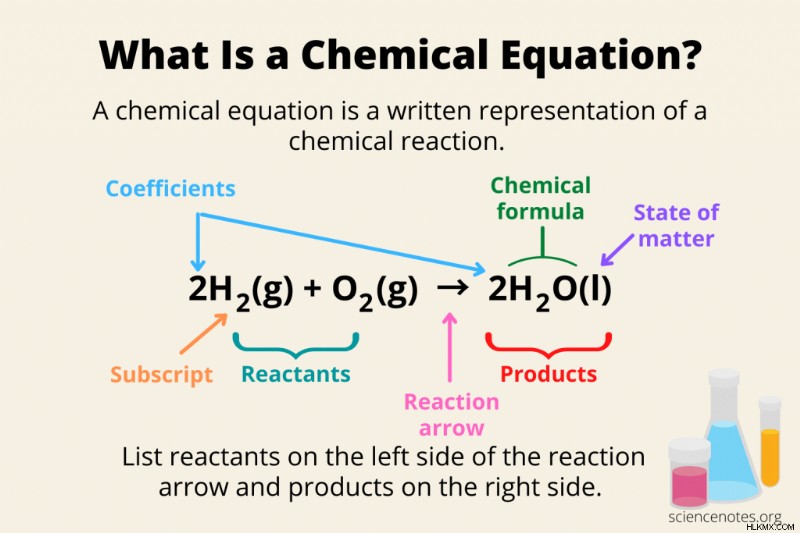
화학 방정식의 일부
화학 방정식의 세 가지 필수 부분은 반응물, 제품 및 반응 화살표이지만 많은 방정식이 훨씬 더 많은 정보를 포함합니다.
- 화학 공식 :반응물 및 제품은 요소 기호 및 첨자를 사용하여 화학 공식으로 작성됩니다.
- 반응물 :관습에 따라 화학 반응은 왼쪽에서 오른쪽으로 읽습니다. 반응물은 방정식의 왼쪽에 기록됩니다. 반응물의 화학 구조를 그리는 것은 괜찮지 만 일반적인 방법은 반응물 화학적 공식을 제공합니다 (예 :h 2 , o 2 ).
- 제품 :화학 반응의 산물은 반응 화살표의 오른쪽에 기록됩니다.
- 반응 화살표 :반응 화살표는 화학 반응이 어떤 방향으로 진행되는지 알려줍니다.
- 플러스 표지판 :둘 이상의 반응물 또는 제품이 발생하면 그 사이에 플러스 부호 (+)를 사용하십시오.
- 계수 :계수는 화학 공식 앞에 기록 된 숫자입니다. 그것들은 반응물과 생성물의 화학량 론을 나타내므로 균형 잡힌 방정식에서 그들 사이의 두더지 비율을 한눈에 볼 수 있습니다. 예를 들어, 식 4H
2 에서 o 2 ,“4”는 계수입니다. 컨벤션에 따라 "1"수는 생략됩니다. 그래서 당신은 o 2 을 씁니다 그리고 1o 2 가 아닙니다 . 일반적으로 계수는 정수이지만 때로는 분수 또는 소수점을 사용하여 방정식이 표시됩니다. - 구독 :첨자는 화학식의 요소 기호를 따릅니다. 예를 들어, h 2 의 "2" O는 첨자입니다.
- 물질의 상태 :모든 화학 방정식이 반응물 및 제품 문제 상태를 나열하는 것은 아닙니다. 그러나 주어진 경우, 물질 상태는 괄호 안에 둘러싸인 반응물 또는 생성물의 화학적 공식을 따릅니다. 물질 상태에 대한 약어는 고체의 경우 (S), 액체의 경우 (L), 가스의 경우 (g), 종이 수용액에 용해 될 때 (aq)입니다.
화학 방정식에서의 반응 화살표
반응 화살표의 유형은 화학 반응이 진행되는 방향을 설명합니다.
- 가장 일반적인 반응 화살표는 왼쪽에서 오른쪽으로 가리 킵니다. 기호 →는 반응이 순방향 방향으로 진행되는 것을 의미하며, 여기서 반응물이 반응하고 생성물을 생산합니다.
- 일부 방정식은 평형을 보여줍니다. 기호 ⇌는 반응물과 생성물 사이의 화학적 평형 조건을 나타냅니다. 반응은 양방향으로 진행되며, 방정식의 양쪽은 반응물 및 생성물로 동시에 작용합니다. 한 화살표가 다른 화살표보다 짧은 경우, 더 긴 화살표는 반응이 진행되는 1 차 방향을 나타냅니다. 반응이 짧은 화살표는 반응이 여전히이 방향으로 발생하지만 선호되지 않습니다. .
- 기호 symbol symbol는 반응이 앞뒤 방향으로 진행됨을 의미합니다.
- 동일한 부호 또는 =는 화학량 론적 관계를 나타냅니다.
불균형 및 균형 화학 방정식
화학 방정식은 불균형이거나 균형이 맞습니다.
- 불균형 화학 방정식은 반응물과 생성물과 반응이 진행되는 방향을 나열하지만 반응물과 생성물 사이의 두더지 비율을 지정하지는 않습니다.
예 :h 2 + o 2 → h 2 영형
- 균형 화학 방정식에는 화학 공식 이전의 계수가 포함되며 반응물과 생성물 사이의 화학량 론적 비율을 나타냅니다. 균형 잡힌 화학 방정식은 반응 화살표의 양쪽에 동일한 수와 유형의 원자를 포함합니다. 질량과 전하 모두에 대해 균형을 이룹니다.
예 :2h 2 + o 2 → 2h 2 o
이온 화학 방정식
이온 화학 방정식은 반응물 및 제품에 대한 순 전하를 나타냅니다. 균형 잡힌 이온 방정식에서 순 전하는 반응 화살표의 양쪽에서 동일합니다.
예 :2Ag (aq) + cr 2 o 7 (aq) → Ag
계수에 충전을 곱합니다. 이 예에서는은 이온에 대한 두 가지 "+"전하와 크로메이트 이온에 대한 두 가지 "-"하전이 있습니다. 이 전하는 서로를 취소하여 방정식 [2 (+1) + 1 (-2) =0]의 반응물쪽에 순 중립 전하를 남깁니다. 은 크로메이트 제품은 전기적으로 중립적입니다.
참조
- Brady, James E.; Senese, Frederick; Jespersen, Neil D. (2007). 화학 :물질과 그 변화 . John Wiley &Sons. ISBN 9780470120941.
- iupac (1997). "화학 반응 방정식." 화학 용어의 개요 (제 2 판) (“골드 북”). 옥스포드 :Blackwell Scientific Publications. ISBN 0-9678550-9-8. doi :10.1351/Goldbook
- 마샬, 휴 (1902). "화학 표기법에 사용하기위한 평등의 징후의 제안 된 수정". 에든버러 왕립 학회의 절차 . 24 :85–87. doi :10.1017/s0370164600007720
- Myers, Richard (2009). 화학의 기초 . 그린 우드 출판 그룹. ISBN 978-0-313-31664-7.
- van‘T Hoff, J.H. (1884). études de dynamique Chemique [화학 역학 연구] (프랑스어). 암스테르담, 네덜란드 :Frederik Muller &Co.