화합물의 이성질체는 동일한 화학적 공식이지만 다른 공간 방향 또는 구조적 배열을 갖는 분자로 정의 될 수있다.
간단한 유기 분자-펜탄 (C5H12)의 예를 들어 봅시다.
h3c-ch2-ch2-ch2-ch3 (직선 체인)
h3c-ch (ch3) -CH2-CH3 (하나의 메틸 그룹이 왼쪽으로부터 두 번째 탄소에 부착 된 분기 체인)
h3c-c (CH3) 2-CH3 (4 개의 메틸기가 부착되는 탄소 원자가 있습니다)
위의 모든 것은 동일한 화학적 공식이지만 다른 구조를 갖는 펜탄의 이성질체입니다.
이성질체는 구조적 이성질체와 입체 소성기의 두 가지 유형 일 수 있습니다. 전자에서, 화학적 공식은 동일하지만, 분자와 원자의 연결은 펜탄 예에서 볼 수 있듯이 다를 수있다.
그러나 입체 소성 작용에서는 공간 배열에만 차이가 있습니다. 입체 이성질체는 기하학적 및 광학 이성질체로 더 나눌 수 있습니다.
조정 화합물에서의 기하학적 이성질체 노트
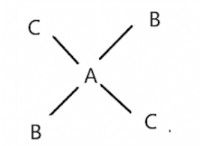
둘 이상의 리간드가 금속에 부착되어야합니다. 즉, 화합물은 이질적이어야합니다.
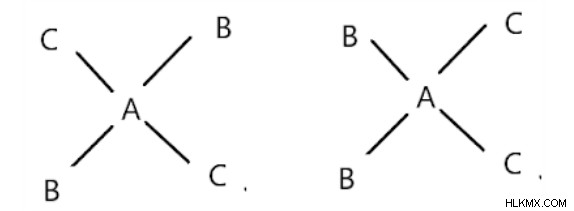
형태의 사각형 평면 화합물 AB2C2 :
cis 및 trans forms에 존재합니다. 트랜스는 같은 리간드가 서로 반대 일 때입니다.
트랜스 양식 cis form
첫 번째 구조는 트랜스이고 두 번째 구조는 cis입니다.
[pt (nh3) 2cl2]
의 예를 들어 봅시다. 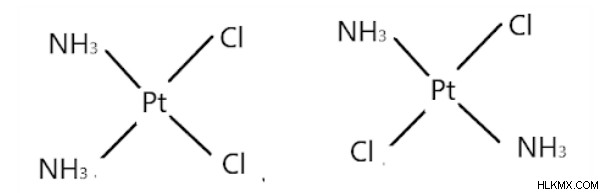
cis 양식 양식
첫 번째 화합물은 cis-diamminedichloroplatinum (II)입니다. 두 개의 염화물 이온이 서로 인접 해 있으며 2 개의 아민 분자가 서로 인접 해 있습니다.
두 번째 화합물은 트랜스-디암 미네 디클로로 플라 티늄 (II)입니다. 두 아민과 염화물 분자는 각각 서로 반대쪽으로 배치됩니다.
양식 AB2C4 :
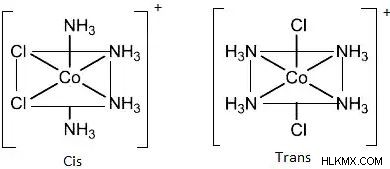
의 팔면체 화합물그들은 B의 위치에 따라 CIS 및 트랜스 형태로 존재합니다. b가 서로 반대되는 경우, 우리는 트랜스 이성질체를 얻는다; 그렇지 않으면, 우리는 시스-이성질체를 얻습니다.
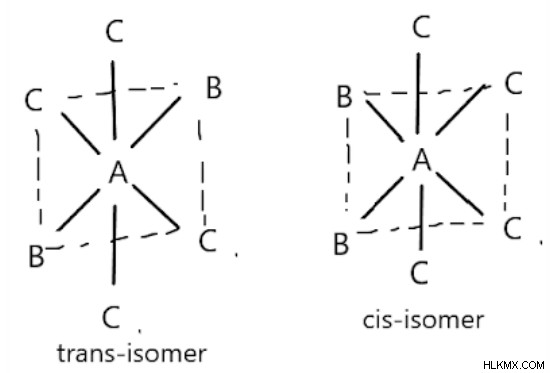
화합물 [CO (NH3) 4CL2]+는 시스 및 트랜스 형태에 존재하는 팔면체 화합물이다. 첫 번째 그림은 시스-이성질체를 나타내고, 두 번째 그림은 화합물의 트랜스 이성질체를 보여줍니다.
양식 AB3C3 :
의 팔면체 화합물그들은 FAC 및 MER 형태로 존재합니다. FAC 형태는 팔면체의 인접한 정점에 리간드가있을 때입니다. MER 형태에서, 동일한 유형의 한 쌍의 리간드가 왼쪽 그림과 같이 서로 반대됩니다. 리간드는 오른쪽 그림과 같이 다면체의 자오선 주위에 위치 된 것으로 알려져 있습니다.
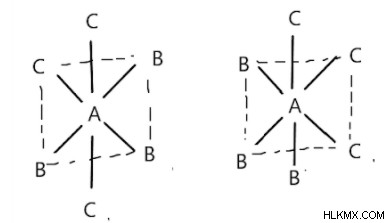
MER Isomer FAC Isomer
[CO (NH3) 3 (NH3) 3]은 다음과 같이 FAC와 MER 형태에 존재합니다.
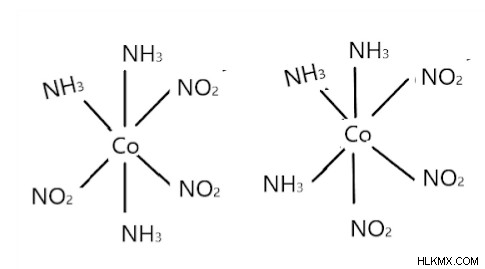
왼쪽은 mer이고 오른쪽은 fac입니다.
조정 화합물에서광학 이성질체 노트
조정 화합물의 광학 이성질체는 부적절하지 않은 미러 이미지입니다. 중심 금속 이온에 조정 된 바이던 테이트 리간드를 갖는 팔면체 화합물에서 가장 일반적으로 관찰된다. 예를 들면 :[CO (en) 3] 3+
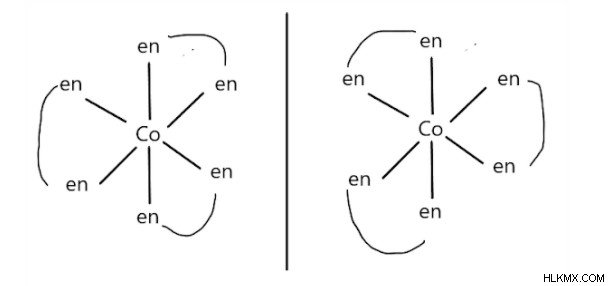
왼쪽 이성질체는 덱스 트로이며 (오른쪽 방향으로 편광 평면을 회전 함), 오른쪽 이성질체는 Laevo입니다 (왼쪽 방향으로 편광 평면을 회전시킵니다).
.조정 화합물에서의 구조적 이성질체
다음 유형으로 더 분류 할 수 있습니다 :
-
연결 이성질체
-
조정 이성질체
-
이온화 이성질체
-
솔 베이트 이성질체
-
조정 화합물에서의 연결 이성질체
이 유형의 이성질체는 앰비던트 리간드를 갖는 복합체에 존재한다. 리간드는 2 개의 공여체 부위를 통해 금속 이온과 조정될 수있다. 앰비던스 리간드의 예는 질소 원자 또는 황 원자 (NCS-)를 통해 조정될 수있는 티오 시아 네이트 (SCN-)이다.
-
조정 화합물에서의 조정 이성질체
그것은 두 개의 배위 구체를 갖는 화합물에 존재합니다-하나의 양이온 및 1 개의 음이온 성. 리간드는 두 개체간에 교환 될 수 있습니다. 예는 [CO (NH3) 6] [CR (CN) 6]입니다. 이것에서, CO와의 배위 구는 양이온 성이고 다른 하나는 음이온 성이다. 그러나 일단 리간드가 교환되면 [CR (NH3) 6] [CO (CN) 6].
-
조정 화합물에서의 이온화 이성질체
조정 구체 외부의 이온이 금속 중심에 직접 결합 된 리간드를 대체 할 때 발생합니다. [CO (NH3) 5 (SO4)] BR은 카운터 이온으로서 브로마이드를 갖는다. 그러나 Br-는 배위 구체 내부의 황산염을 대체하여 [CO (NH3) 5BR] SO4를 제공 할 수 있습니다.
-
조정 화합물에서 이성질체를 용액으로
그것은 용매가 리간드로 작용하는 이온화 이성질체의 유형입니다. 예를 들어, [CR (H2O) 6] CL3에서, 하나의 염화물 카운터 음이온은 아쿠아 리간드 중 하나를 대체하고 [CR (H2O) 5CL] CL.H2O
가 될 수 있습니다.결론
조정 화합물에서의 이성질체는 구조적 이성질체와 입체 소성기의 두 가지 유형 일 수 있습니다. 입체 소성 작용은 이성질체가 공간 배열 측면에서 다를 때입니다. 기하학적과 광학의 두 가지 유형 일 수 있습니다. 기하학적 이성질체는 시스 및 트랜스 형태 또는 FAC 및 MER 형태에 존재할 수 있습니다. 구조 이성질체는 연결 이성질체, 조정 이성 질환, 이온화 이성질체 및 용매 이성질체의 네 가지 유형으로 분류 될 수 있습니다.