주요 차이 - 강한 대 약산
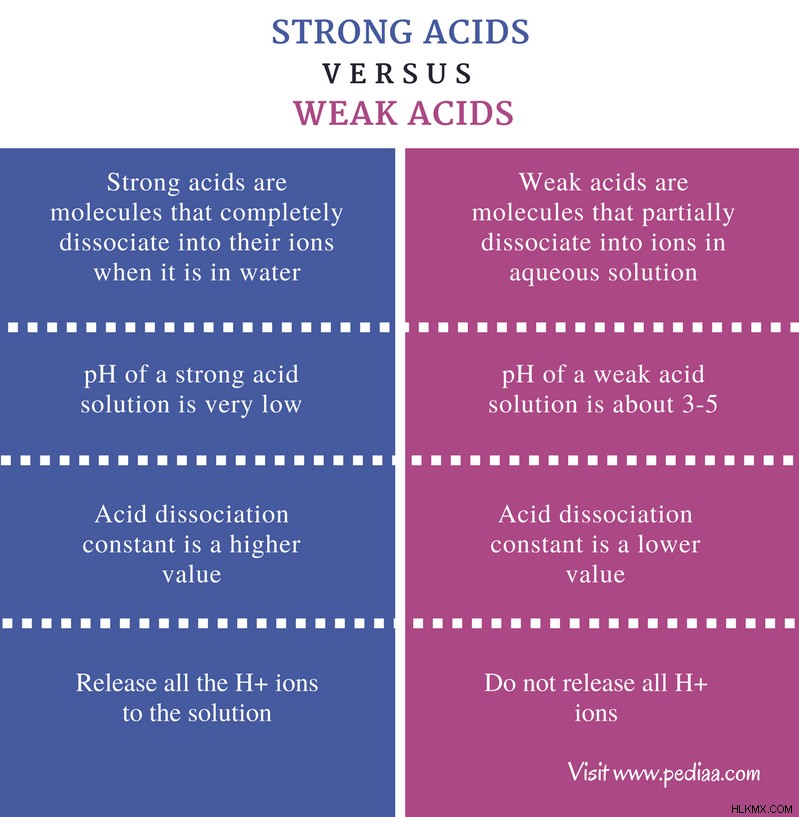
산은 분자 또는 다른 종입니다. 산은 강산 및 약산으로 알려진 두 그룹으로 분류됩니다. 강한 산과 약산의 주요 차이점은 강산이 수용액에 완전히 분리된다는 것입니다 약산은 수용액에 부분적으로 분리됩니다.
주요 영역을 다루었습니다
1. 강한 산
- 정의, 속성, 예
2. 약산이란 무엇입니까
- 정의, 속성, 예
3. 강산과 약산의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :산, 산 해리 상수, 탈 양성자 화, pH, 극성, 양성자, 강산, 약산
강산이란 무엇입니까
강산은 물에있을 때 이온에 완전히 분리되는 분자입니다. 다시 말해, 산은 완전한 이온화에 의해 용액으로 이온을 방출한다. 산의 강도는 산 분리 상수 를 특징으로합니다. 값 (k a ). 일반적으로, 강산은 매우 큰 k a 를 갖는다 값.
산이 강할수록 양성자가 더 쉽게 잃어 버립니다. 이들 양성자는 H 원자와 나머지 분자 사이의 결합의 높은 극성으로 인해 쉽게 방출됩니다. 이 극성 이 결합에 관여하는 2 개의 원자의 전기 음성화에 의해 결정된다. 탈 로토 톤 강산의 (양성자 제거)는 양성자가 부착 된 음이온의 극성과 크기에 달려있다.
예를 들어, H-A라는 산이 고려되면 HA 산의 해리는
로 제공 될 수 있습니다.ha (aq) + h 2 o (l) à a (aq) +h 3 o (aq)
그러나 산 분자에 둘 이상의 양성자가 있다면 아래에서와 같이 표시 될 수 있습니다. 아래 예제는 쌍극 산의 해리를 보여준다. 이것은 두 개의 양성자를 방출 할 수 있음을 의미합니다.
h 2 b (aq) +h 2 o (l) à b (aq) +h 3 o (aq)
반면에, 용액의 pH는 강산이 용액에 H+ 이온을 방출하기 때문에 강산에 의해 크게 영향을받습니다. pH는 H+ 농도에 의존한다. H+ 농도와 pH 사이의 관계는 다음과 같이 주어질 수 있습니다.
ph =-log [h (aq) ]]
산이 강산 인 경우, pH 값은 매우 작은 값입니다. 예를 들어, 강한 모노 프 성산이 0.1 몰 농도에서 물에 있으면 용액의 pH가 될 것입니다.
ph =-log [h (aq) ]
ph =-log [0.1 moll]
=1
강산의 예
- 히드로 클로르 산 (HCl)
- 질산 (hno 3 )
- 황산 (H 2 그래서
4 ) - Hydrobromic Acid (HBR)
- hydroiodic acid (hi)
- 과염소산 (hclo 4 )
- 클로르산 (HCLO 3 )
약산이란 무엇입니까
약산은 수용액에서 이온으로 부분적으로 분리되는 분자입니다. 약산이 용액에 모든 이온을 방출하지는 않습니다. 산 해리 상수 (k a )는 강산보다 작은 값입니다. 용액의 pH는 약 3-5입니다. 이는 약산이 강산과 같이 용액의 H+ 농도를 상승시키지 않기 때문입니다. 물의 약산 시스템에는 용액에 H+ 이온, 분자의 음이온 및 약산 분자가 존재한다.
예를 들어, 에탄 산의 해리는 다음과 같이 표시 될 수 있습니다.

그림 1 :에탄 산의 해리
약한 산의 해리를 쓸 때 단일 화살표 대신 이중 화살표를 사용해야합니다. 이것은 반응이 평형 반응임을 보여주기위한 것입니다.
약산의 예
- 황산 (H 2 그래서
3 ) - 인산 (H 3 po 4 )
- hydrofluoric acid (HF)
- 아질산 (hno 2 )
- 벤조산 (c 6 h 5 COOH)
- 포름산 (Hcooh)
- 아세트산 (ch 3 COOH)
강한 산과 약산의 차이
정의
강산 : 강산은 물에있을 때 이온에 완전히 분리되는 분자입니다.
약산 : 약산은 수용액에서 이온으로 부분적으로 분리되는 분자입니다.
pH
강산 : 강산 용액의 pH는 매우 낮습니다 (약 pH =1)
약산 : 약산 용액의 pH는 약 3-5입니다.
산 해리 상수
강산 : 산 해리 상수 k a 강산에 대한 더 높은 값입니다.
약산 : 산 해리 상수 k a 강산의 값이 낮습니다.
h+ 이온의 양
강산 : 강산은 용액으로 방출 될 수있는 모든 이온을 방출합니다.
약산 : 약산은 모든 이온을 방출하지는 않습니다.
결론
산의 강도는 산 분자의 극성과 원자 크기에 의해 결정됩니다. 산 분자가 물에 분리하는 방식에 따르면, 강산과 약산과 같은 두 가지 유형의 산이 있습니다. 강한 산과 약산의 주요 차이점은 강산이 수용액에 완전히 분리되는 반면, 약산은 수성 용액에 부분적으로 해리된다는 것입니다.