핵심 개념
알칸 유기 화학에서 가장 기본적인 화합물입니다. 그러나, 그것들은 다른 많은 복잡한 화합물의 골격을 형성하기 때문에 매우 중요합니다. 이 기사에서는 Alkane의 구조, 명명법 및 그 반응에 대해 배울 것입니다.
다른 기사에서 다루는 주제
- 의자 형태
- 기능 그룹
- 이름 지정 알칸
- naming cycloalkanes
- 뉴먼 프로젝션
- 입체 방해
- 구조 이성질체
알칸 구조
알칸은 탄화수소 (전적으로 탄소와 수소로 구성된 화합물)이며 결합은 모두 시그마 (σ) 결합이다. 즉, 알칸의 탄소는 서로 단일 결합을 형성하고 수소 원자와 함께 형성합니다. 이러한 이유로 알칸은 포화 탄화수소라고하며, 이중 또는 삼중 결합이 부족하면 각 탄소가 가능한 최대 수소 원자 수에 결합 할 수 있습니다.
.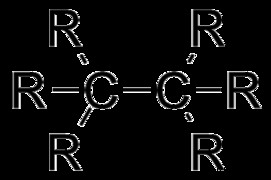
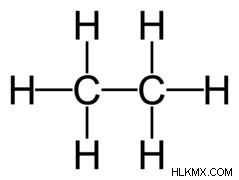
또한, 알칸은 서로 부착되어 분지 된 알칸을 형성 할 수 있습니다. 또는 그들은 주기적 형성에 들어가서 사이클로 알칸을 형성 할 수 있습니다. 우리는이 기사의 나중에이 구조를 더 논의 할 것입니다.
알칸에 대한 빠른 사실
- 구조 :탄소 원자가 서로 단일 결합되어 수소 원자
- 일반 공식 :c n H 2n+2
- pH :중성
- pka :30 이상
- 용해도 :물에 불용성이지만 비극성 유기 용매에 가용성
- C – C 결합 길이 :1.53 Å
- C – C 결합 강도 :356 kJ mol
- IR 분광법 :알칸의 C – H 결합은 약 2850 - 3000 cm에 신호를 제공합니다
알칸 이성질체
구조 이성질체
4 개의 탄소가있는 알칸은 구조 이성질체로 존재할 수 있습니다. 즉, 동일한 분자 공식은 구조가 다른 많은 화합물을 나타낼 수 있습니다. 이 구조 중 하나는 직선 체인 알칸입니다 (각 탄소는 2 개의 다른 탄소에 최대 2 개의 탄소에 결합 할 수있는 곳)이며 나머지는 알칸이 분지되어 있습니다 (각 탄소는 최대 4 개의 다른 탄소에 결합 할 수 있습니다).
.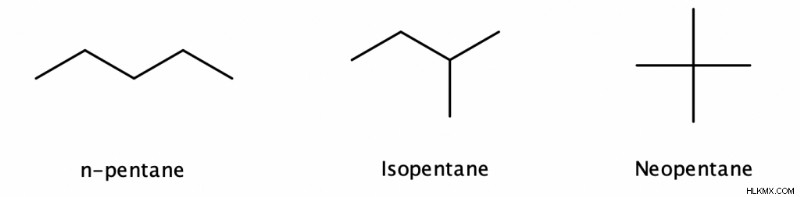
Alkane의 탄소가 많을수록 구조적 이성질체가 더 많을 수 있습니다. 예를 들어, C 5 H 12 3 개의 이성질체가 있고 C 9 H 20 35 개의 이성질체가 있습니다.
컨 포머
알칸은 C -C 결합 주위를 자유롭게 회전시킬 수 있으므로 다양한 모양 (또는 "형태")로 3D 공간에 존재할 수 있습니다. 당신의 팔을 생각하십시오 :당신은 당신이 원하는 방식으로 어떤 식 으로든 비틀고 구부릴 수 있지만 여전히 팔이 될 것입니다. 팔의 구조는 변하지 않고 모양 만 변하지 않습니다. 일부 알칸 형태는 안정적이고 (에너지가 낮음), 일부는 불안정 (에너지가 높음)입니다.
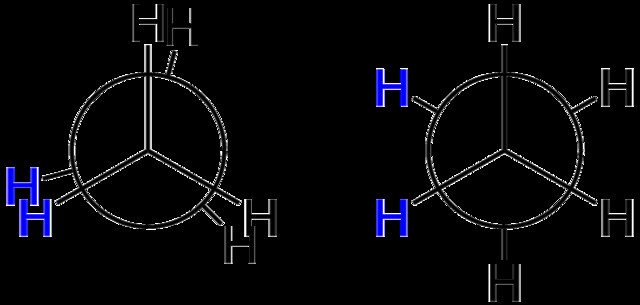
Newman Projection
우리는이 기사 에서이 주제를 광범위하게 다루었습니다. Newman Projections.
기본적으로, 뉴먼 프로젝션은 두 명의 천장 선풍기가 서로 위에 붙어 있다고 생각하십시오. 블레이드가 서로 멀어 질수록 형태가 더 안정적입니다.
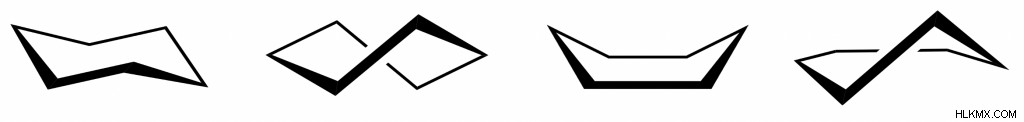
사이클로 헥산 형태
사이클로 헥산은 많은 모양으로 비틀어 질 수 있지만 가장 잘 알려진 것은 의자 형태 일 것입니다. 의자 형태가 사이클로 헥산의 가장 안정적인 형태이기 때문입니다. 의자는 각도 변형, 일식 균주 및 작은 입체 변형을 경험하지 않습니다.
사이클로 헥산의 다른 인기있는 형태는 (내림차순으로) :트위스트 보트, 보트 및 하프 의자.
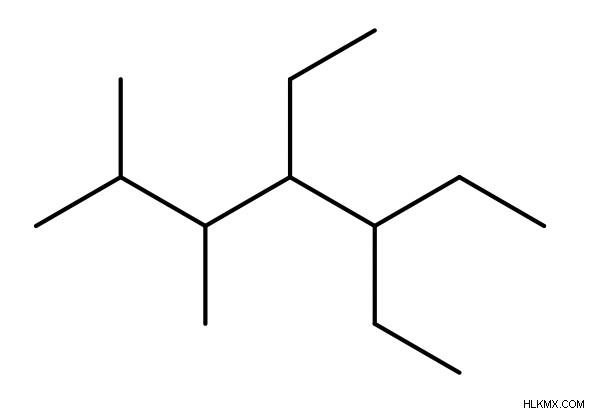
알칸 명명법
우리는이 기사 에서이 주제를 광범위하게 다루었습니다. 이름 지정 알칸, 사이클로 알칸을 명명했습니다. 따라서 다음 정보는 새로 고침입니다.
이름 지정 알칸
- 다른 기능 그룹이없는 Alkane (순수한 Alkane)을 지명하려면 먼저 가장 긴 체인 인 부모 체인을 식별합니다 (가장 많은 수의 탄소로 구성)
- 그런 다음 "-yl"앞에 접두사를 추가하여 치환기의 이름을 지정합니다 (있는 경우). 이 접두사는 부모 체인의 이름 (예 :Meth, ETH, Prop 등)에 사용되는 접두사와 동일합니다. 여기에 메틸, 에틸 및 프로필이 몇 가지 예입니다.
- 다음으로, 우리는 분자 내의 위치를 나타 내기 위해 각 치환기에 숫자를 할당합니다. 우리는 가능한 가장 낮은 숫자를 만나는 첫 번째 치환기에 할당해야합니다. 넥타이가있는 경우, 우리는 가능한 가장 낮은 숫자를 만나는 두 번째 치환기를 지정하기 위해 움직입니다 (그러나 여전히 첫 번째 치환기보다 더 높음) .
- 또한, 대체 요소 앞에 Di, Tri, Tetra와 같은 다른 접두사 세트를 부착하여 분자에 그러한 종류의 치환기가 얼마나 많이 존재하는지를 나타냅니다. .
- 마지막으로, 우리는 접미사“ane”을 분자 이름의 끝에 부착합니다.
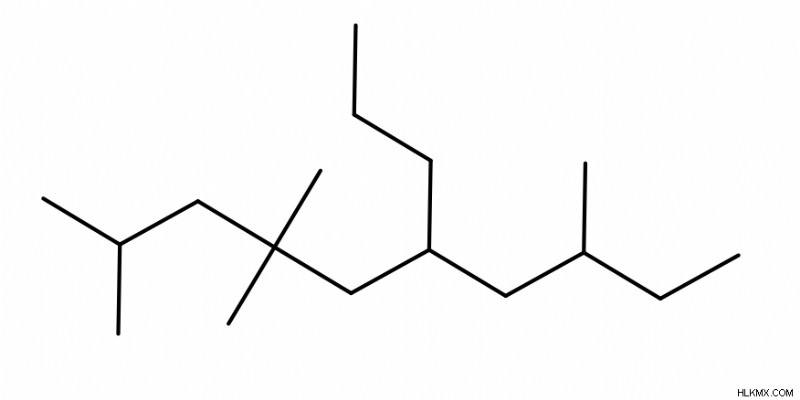
사이클로 알칸을 명명
링이 부모 체인 인 경우 (즉, 탄소 원자가 가장 많음), 부모 체인의 이름 앞에 접두사 "Cyclo"를 추가합니다.
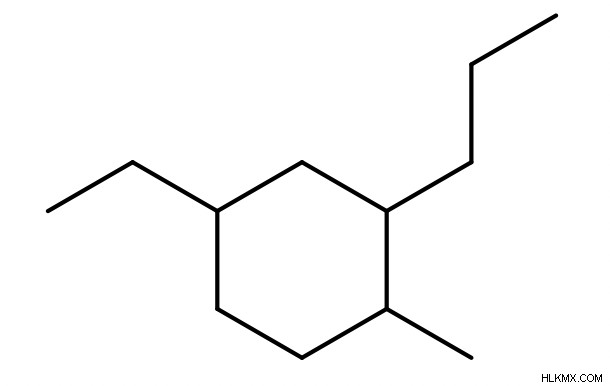
.링이 단지 치환기라면 (즉, 링보다 더 긴 탄소 사슬이 존재 함), 우리는 상기 링 치환기의 이름 앞에 접두사 "사이클로"를 추가합니다.
.
자전거 화합물 명명
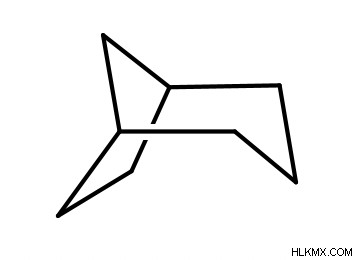
두 고리가 서로 융합 될 때 자전거 화합물이 형성됩니다. 고리가 융합 된 두 개의 탄소를 "Bridgeheads"라고합니다. 자전거 화합물의 이름 지정 형식은 다음과 같습니다. 치환기 + 자전거 [A.B.C] + 부모 이름.
우선, 우리는 두 개의 융합 고리를 형성하는 총 탄소 수를 계산하여 부모 이름을 알아냅니다. 다음으로, Bridgeheads를 제외하고, 우리는 한 링의 탄소 수, 다른 링의 탄소 수 및 Bridgeheads 사이의 탄소 수를 계산합니다. 그런 다음 그 숫자가 가장 높거나 낮은 것에서 가장 낮은 것부터 A, B 및 C의 순서에 해당합니다 (A는 가장 높고 C는 가장 낮습니다).
.
알칸과의 반응
일반 반응 경향
알칸은 매우 불활성이며 많은 반응을 겪지 않습니다. 이러한 이유로 화학자들은 기능 그룹을 나열 할 때 종종 알칸을 생략합니다. 그럼에도 불구하고, 알칸의 연소 반응은 화학에서 더 잘 알려진 반응 중 하나이며, 알칸의 할로겐화는보다 복잡한 분자를 합성하는데 유용 할 수있다.
.알칸의 준비
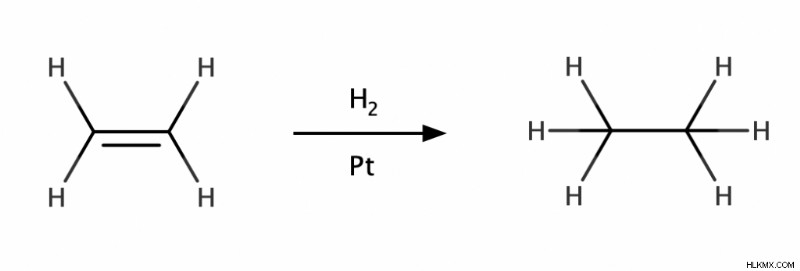
alkenes에서알켄은 우리에게 알칸을주기 위해 수소화 반응을 겪을 수 있습니다. 수소화 반응에서, 분자 수소 (H <서브> 2 )는 Pt, PD 또는 Ni와 같은 금속 촉매의 존재하에 알켄의 이중 결합을 가로 질러 첨가된다. 동일한 반응은 알키네에서 수행되어 동일한 결과를 생성하여 2 개의 H 2 를 추가합니다. 분자.
 카르 보닐의
카르 보닐의 화학자들이 카르 보닐 (알데히드 및 케톤)을 알칸으로 줄이는 데 사용하는 두 가지 인기있는 방법이 있습니다.
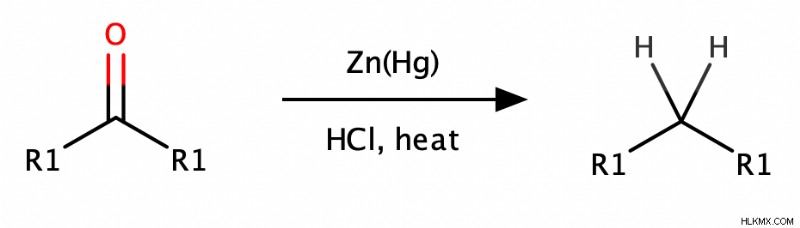
- Clemmensen 감소는 산성 조건 하에서 아연 아모걸 (아연과 수은의 합금 인 아연)으로 카르 보닐을 처리하는 것과 관련이 있습니다.
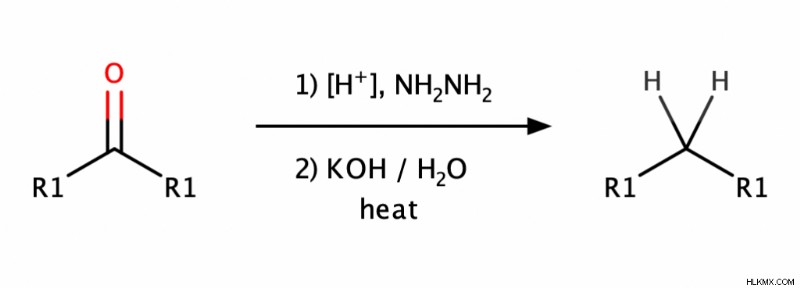
- Wolff – Kishner 감소는 먼저 카르 보닐을 히드라진으로 처리함으로써 히드라곤의 형성을 포함한다 (NH 2 nh 2 ) 그런 다음 기본 조건 하에서 상기 히드라전의 감소.
알칸의 반응
완전 연소
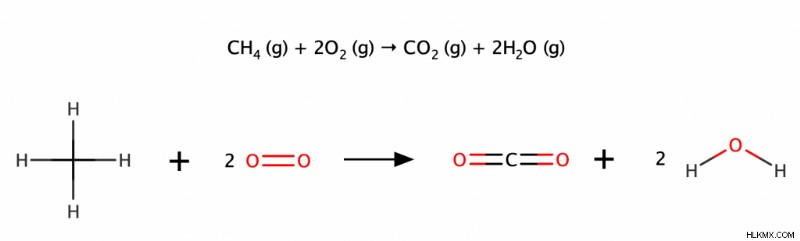
완전한 연소는 산소의 과도한 존재에서 알칸의 연소를 포함합니다. 보다 구체적으로, 이산화탄소와 물을 생산하기 위해 알칸의 산소 가스와의 조합을 포함한다. 반응은 매우 발열 적이며 결과적으로 열과 빛을 방출합니다.
불완전한 연소
불완전한 연소 반응은 완전한 연소 반응과 매우 유사합니다. 그들은 모두 발열과 열과 빛을 방출합니다. 주요 차이점은 불완전한 연소에서 알칸이 산소 가스의 제한된 (불충분 한) 공급으로 연소된다는 것입니다. 결과 생성물은 물과 일산화탄소 (매우 독성이 있음) 또는 탄소입니다. 이유를 이해하기 위해, 우리는 연소 반응에서 알칸의 모든 결합이 깨지고 수소 원자가 먼저 산화된다 (물 형성)를 기억해야한다. 산소의 공급은 제한되어 있기 때문에 탄소가 이산화탄소를 형성하기에 충분한 산소가 남아 있지 않습니다. 따라서, 산소의 공급이 더 제한적이라면 탄소는 일산화탄소 또는 탄소에 정착해야합니다.
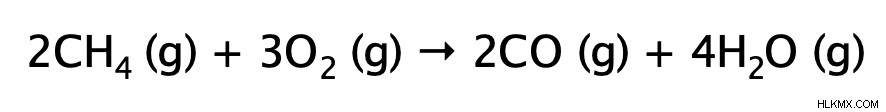
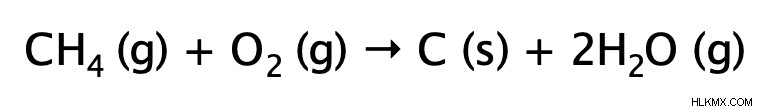
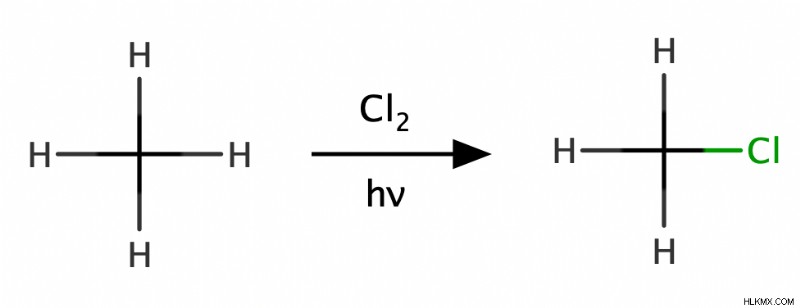
할로겐화
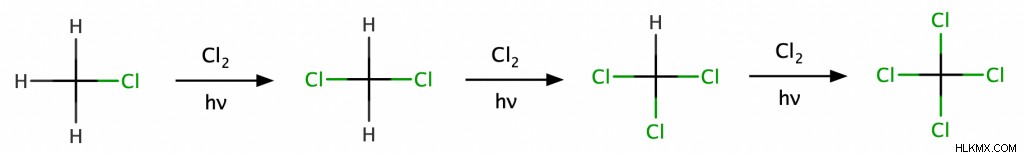
알칸의 브롬화 및 염소화는 가장 인기있는 자유 라디칼 반응 중 하나입니다. 이 예에서, 우리는 메탄을 cl 2 로 처리함으로써 메탄의 염소화를 달성합니다. 열이나 빛과 같은 에너지 원이있을 때. 이것은 메탄의 수소 중 하나가 염소 원자로 대체되어 클로로 메탄을 형성합니다 (ch 3 . cl). 따라서, 화학자들은이 반응을 치환 반응으로 분류한다. 또한, 과량의 cl 2 에 따라 IS, 클로로 메탄은 추가 염소화를 거쳐 디클로로 메탄을 형성 할 수있다 (ch 2 cl 2 ), 클로로포름 (CHCL 3 ) 또는 탄소 테트라 클로라이드 (CCL <서브> 4 ).
추가 판독
- 아미노 기능 그룹
- 카르 복실 산 기능성 그룹
- Grignard 시약
- 임계 요소 탄소