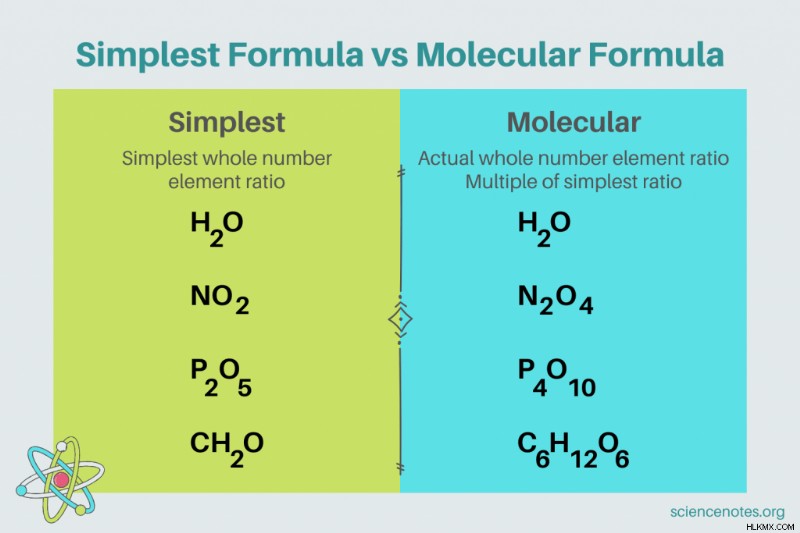
화학에서 가장 단순한 공식 요소의 가장 작은 정수 비율을 보여주는 화합물의 화학적 공식입니다. 공식은 요소 기호로 구성되며, 원자 수를 나타내는 위시가 이어집니다. 요소의 단일 원자가있는 경우 첨자를 생략하십시오. 가장 간단한 공식의 또 다른 이름은 경험적 공식입니다. 대조적으로, 분자식은 가장 단순하거나 경험적 공식의 다중이며 화합물에서 요소의 실제 정수 비율을 제공합니다.
.가장 간단한 공식 예
예를 들어, 물의 가장 간단한 공식은 H 2 입니다 O. 물에 산소의 모든 두더지에 2 몰의 수소가 있습니다. 이 경우 가장 간단한 공식과 분자 공식은 동일합니다.
대조적으로, 포도당의 가장 간단하고 분자 공식은 서로 다릅니다. 가장 간단한 공식은 ch 2 입니다 O, 분자 공식은 c 6 입니다 H 12 o 6 . 분자식은 가장 간단한 공식의 배수이며 각 첨자에 6을 곱합니다.
예제 문제 :질량 퍼센트 구성에서 가장 간단한 공식
문제
이 개념의 일반적인 적용은 질량 조성에서 화합물의 가장 간단한 공식을 찾는 것입니다. 예를 들어, 요소의 질량 백분율이 다음과 같은 비타민 C의 가장 간단한 공식을 찾으십시오.
- c =40.9
- h =4.58
- o =54.5
솔루션
이 문제를 해결하는 가장 쉬운 방법은 100 그램의 샘플이 있다고 가정합니다. 이런 식으로 질량 퍼센트 값은 샘플 질량 (100 그램)과 동일한 숫자 (100%)에 추가됩니다.
다음으로 주기율표를 사용하고 요소의 원자 질량을 찾으십시오.
- h는 1.01 입니다
- C는 12.01 입니다
- o는 16.00 입니다
원자 질량을 알면 몰라-그램 전환 계수가 있습니다. 각 요소의 두더지 수를 계산하십시오 :
- c =40.9 g c x 1 mol c / 12.01 g c =3.41 mol c
- h =4.58 g H x 1 mol H / 1.01 g H =4.53 mol H
- o =54.5 g o x 1 mol o / 16.00 g o =3.41 mol o
남아있는 것은 요소의 가장 작은 정수 비율을 찾는 것입니다. 각 요소의 두더지 수를 적은 수로 나누어서이를 수행하십시오. 이 경우 가장 작은 숫자는 3.41 몰 (C 및 O 모두)입니다.
- C :3.41 / 3.41 =1.00
- H :4.53 / 3.41 =1.33
- o :3.41 / 3.41 =1.00
1 :1.33 :1의 비율은 정수 비율이 아닙니다. 바라건대, 당신은 1.33이 분수 4/3과 거의 동일하다는 것을 알고 있습니다. 그렇지 않다면 약간의 연습으로 일반적인 분수를 인식하게됩니다. 요소 비율은 1 C :4/3 H :1 O입니다. 마지막으로, 각 숫자에 분수 분모 (3)를 곱하여 분수를 제거하고 정수를 얻습니다. 이것은 당신에게 3 c :4 h :3 o를 제공합니다. 이것을 화학적 공식으로 바꾸십시오.
비타민 C의 가장 간단한 공식은 C 3 입니다 H 4 o 3 .
참조
- 버로우, 앤드류. (2013). 화학 :무기, 유기 및 물리 화학 도입 (제 2 판). 옥스퍼드. ISBN 978-0-19-969185-2.
- Hill, Edwin A. (1900). “화학 문헌을 색인화하는 시스템; 미국 특허청의 분류 부서에서 채택”. J. AM. 화학 사회 22 (8) :478–494. doi :10.1021/ja02046a005
- Petrucci, Ralph H.; Harwood, William S.; 청어, F. Geoffrey (2002). 일반 화학 :원리 및 현대 응용 (8th ed.). 상단 새들 강, 뉴저지 :프렌 티스 홀. ISBN 978-0-13-014329-7.